题目内容
9.根据要求填空(1)固体氧化物燃料电池的工作原理如图1所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动.
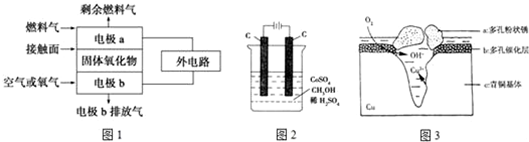
①O2-移向负极(填“正”或“负”).
②当燃料气为C2H4时,其负极反应式为:C2H4+6O2--12e-═2CO2+2H2O.
(2)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图2所示装置模拟上述过程,则Co2+在阳极的电极反应式为Co2+-e-=Co3+;除去甲醇的离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
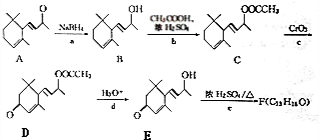
(3)如图3为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
①环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
②若生成4.29g Cu2(OH)3Cl,则理论上耗氧气体积为0.448L(标准状况)
分析 (1)①O2-向负极移动;
②当燃料气为C2H4时,其正极发生还原反应、负极发生氧化反应;
(2)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
(3)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.05mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积.
解答 解:(1)①原电池工作时,O2-向负极移动,故答案为:负;
②当燃料气为C2H4时,其正极发生还原反应电极反应为:3O2+12e-═6O2-;负极发生氧化反应,电极反应式为:C2H4+6O2--12e-═2CO2+2H2O,
故答案为:C2H4+6O2--12e-═2CO2+2H2O;
(2)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:Co2+-e-=Co3+;6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
(3)①Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
②n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子得n(O2)=$\frac{0.02mol×2×2}{4}$=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,
故答案为:0.448.
点评 本题考查了燃料电池的工作原理以及电极反应式的书写等知识,为高频考点,侧重于学生的分析、计算能力的考查,注意把握原电池的工作原理,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 原子半径:B>A,离子半径:C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且有漂白性 |
| A. | 乙酸 | B. | 乙醇 | C. | 油脂 | D. | 氯化钠 |
| A. | 二氧化硅 硅酸盐 | B. | 四氯化硅 硅酸 | ||
| C. | 碳化硅 硅酸钠 | D. | 硅 硅酸盐 |
| A. | 高于-0.5℃ | B. | 约是+30℃ | C. | 约是-40℃ | D. | 低于-89℃ |
| A. | CO的燃烧热为566 kJ/mol | |
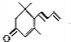
| B. | 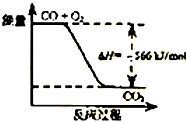 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA |
| A. | 将NH3通入AgN03溶液中,再加几滴葡萄糖溶液,加热后有银镜产生,证明葡萄糖有氧化性 | |
| B. | 配制Fe(N03)2溶液时,向Fe(N03)2溶液中加几滴稀硫酸,以防止Fe(N03)2发生水解 | |
| C. | 向NaI溶液中加入少量CCl4振荡,未见蓝色,说明NaI没有变质 | |
| D. | 剪取一小块铝箔,投入到NaOH溶液中,观察到在被剪断处先产生气体,说明铝在空气中易被氧化 |
| A. | 液化石油气(LPG)的主要成份是碳氢化合物 | |
| B. | 氮氧化物和氟氯烃的排放引发臭氧空洞 | |
| C. | CHCl3不存在同分异构体,可以证明甲烷是以碳原子为中心的正四面体结构 | |
| D. | 沸点:正丁烷>异丁烷 |
 .(已知一个碳原子上不能连接两个碳碳双键)
.(已知一个碳原子上不能连接两个碳碳双键)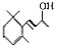 +CH3COOH$→_{△}^{浓硫酸}$、
+CH3COOH$→_{△}^{浓硫酸}$、 +H2O.
+H2O.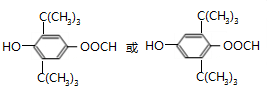
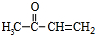 为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线.
为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线. $→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$
$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$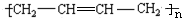 .
.