题目内容
14.利用如图所示装置可制取 H2,两个电极均为惰性电极,c 为阴离子交换膜.下列叙述正确的是( )
| A. | a 为电源的正极 | |
| B. | 工作时,OH-向左室迁移 | |
| C. | 右室电极反应为:C2H5OH+H2O-4e-═CH3COO-+5H+ | |
| D. | 生成 H2 和 CH3COONa 的物质的量之比为 2:1 |
分析 A.根据图知,Pt电极上有氢气生成,说明Pt电极上得电子发生还原反应,为阴极,则Pd为阳极,连接阴极的电极为电源负极;
B.Pt为阴极、Pd为阳极,电解时,电解质溶液中OH-向阳极移动;
C.右室中电解质溶液呈碱性,所以不能有H+生成,乙醇失电子和OH-反应生成CH3COO-和水;
D.根据转移电子相等计算生成的H2 和 CH3COONa 的物质的量之比.
解答 解:A.根据图知,Pt电极上有氢气生成,说明Pt电极上得电子发生还原反应,为阴极,则Pd为阳极,连接阴极的电极为电源负极,所以a为负极、b为正极,故A错误;
B.Pt为阴极、Pd为阳极,电解时,电解质溶液中OH-向阳极移动,则工作时,OH-向右室迁移,故B错误;
C.右室中电解质溶液呈碱性,所以不能有H+生成,乙醇失电子和OH-反应生成CH3COO-和水,电极反应式为C2H5OH+5OH--4e-═CH3COO-+4H2O,故C错误;
D.生成1mol氢气转移2mol电子,生成1molCH3COONa 转移4mol电子,所以生成 H2 和 CH3COONa 的物质的量之比为 2:1,故D正确;
故选D.
点评 本题考查电解原理,为高频考点,侧重考查学生图象观察、分析、判断能力,明确电解原理特点及反应类型与电极的关系是解本题关键,难点是阳极电极反应式的书写,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列有关化学反应速率的说法正确的是( )
| A. | 用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 | |
| B. | 锌和稀硫酸反应制氢气时,加入少量CuSO4溶液,可加快反应速率 | |
| C. | 增大压强、升高温度和使用催化剂均一定使反应速率加快 | |
| D. | 在碳酸钙和盐酸反应中,加多些碳酸钙可使反应速率明显如快 |
1.如图表示某个化学反应过程的能量变化.该图表明( )


| A. | 催化剂可以改变该反应的热效应 | B. | 该反应是个放热反应 | ||
| C. | 反应物总能量低于生成物 | D. | 化学反应遵循质量守恒定律 |
2.下列叙述中正确的是( )
| A. | 化学反应过程中,旧键断裂放出能量,新键生成吸收能量 | |
| B. | 常温下,任何酸、碱间反应,每生成1mol水时的中和热都相同 | |
| C. | 放热反应在常温下都能自发进行 | |
| D. | 升高温度使活化分子百分数增大,反应速率增大 |
6.下列物质中,没有顺反异构体的是( )
| A. | 2-丁烯 | B. | 1,2-二氯乙烯 | C. | 2-甲基-2-丁烯 | D. | 2-氯-2-丁烯 |
3.将20mLNO2和NH3的混合气体,在一定条件下充分反应,化学方程式是:6NO2+8NH3═7N2+12H2O.已知参加反应的NO2比参加反应的NH3少2mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH3的物质的量之比是( )
| A. | 3:2 | B. | 2:3 | C. | 3:5 | D. | 3:4 |
4.下列有关化学用语表达正确的是( )
| A. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| B. | 硫酸的电离方程式:H2SO4═H22++SO42- | |
| C. | HF的电子式: | |
| D. | 35Cl-和37Cl-离子结构示意图均可以表示为: |
 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.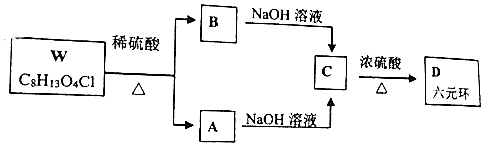
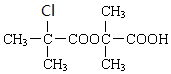 +H2O$→_{△}^{浓硫酸}$
+H2O$→_{△}^{浓硫酸}$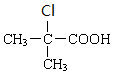 +
+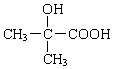 .
.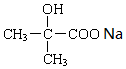 +2NaCl+H2O.
+2NaCl+H2O.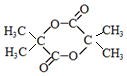 .
.