题目内容
13.(1)在25℃下,将0.01mol•L-1的氨水与0.01mol•L-1的盐酸混合,若等体积混合时,溶液显酸性(填“酸”“碱”或“中”),用化学用语解释原因NH4++H2O?NH3•H2O+H+,溶液中各离子浓度大小关系是c(Cl-)>c(NH4+)>c(H+)>c(OH-);若反应后溶液中c(NH4+)=c(Cl-),则溶液显中性(填“酸”“碱”或“中”),溶液中各离子浓度大小关系是c(Cl-)=c(NH4+)>c(H+)=c(OH-).(2)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu (OH)2沉淀(填化学式),此沉淀为蓝色,生成该沉淀的离子方程式为Cu2++2 NH3•H2O=Cu (OH)2↓+2NH4+.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.
分析 (1)将0.01mol•L-1的氨水与0.01mol•L-1的盐酸混合,若等体积混合时,得到的溶液是氯化铵,铵根离子水解显示酸性,溶液中存在电荷守恒关系:c(NH4+)+c(Na+)=c(Cl-)+c(c(OH-),据此回答;
(2)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,据此回答.
解答 解:(1)将0.01mol•L-1的氨水与0.01mol•L-1的盐酸混合,若等体积混合时,得到的溶液是氯化铵,铵根离子水解显示酸性,即NH4++H2O?NH3•H2O+H+,溶液中存在电荷守恒关系:c(NH4+)+c(H+)=c(Cl-)+c(c(OH-),若反应后溶液中c(NH4+)=c(Cl-),则c(H+)=c(OH-),存在c(Cl-)=c(NH4+)>c(H+)=c(OH-)故答案为:酸;NH4++H2O?NH3•H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);中;c(Cl-)=c(NH4+)>c(H+)=c(OH-);
(2)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,为蓝色;反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu (OH)2;蓝;Cu2++2 NH3•H2O=Cu (OH)2↓+2NH4+.
点评 本题考查Ksp的计算,根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
4.下列说法正确的是( )
| A. | 浓硫酸稀释时应注意将浓硫酸缓缓地倒入盛有水的容量瓶中 | |
| B. | 将11.2L HCl溶于水形成1L溶液,所得溶液的物质的量浓度为0.5mol/L | |
| C. | 0.5mol/L的Na2SO4和1mol/L的NaOH溶液,c(Na+)相同 | |
| D. | 将20g NaOH 溶于1L水中即得到0.5mol/L的NaOH溶液 |
18.40gNaOH固体配成2L溶液,其物质的量浓度为( )
| A. | 0.5mol/L | B. | 5mol/L | C. | 10mol/L | D. | 20mol/L |
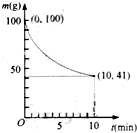 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为: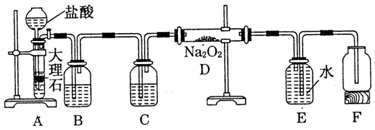

 .
.