题目内容
2.Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O(1)浓盐酸在反应中显示出来的性质是B (填写字母).
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3mol Cl2,则转移的电子的物质的量为0.3 mol.
(3)此反应的离子反应方程式为ClO-+Cl-+2H+=Cl2↑+H2O.
(4)用双线桥法表示该氧化还原反应中电子转移的方向和数目
 .
.
分析 Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O中Cl元素的化合价由+1价降低为0,Cl元素的化合价由-1价升高为0,以此来解答.
解答 解:(1)浓盐酸在反应中生成氯气体现还原性,生成氯化钙体现酸性,显示出来的性质是B,故答案为:B;
(2)由反应可知生成2mol氯气转移2mol电子,则产生0.3mol Cl2,则转移的电子的物质的量为0.3mol,
故答案为:0.3;
(3)此反应的离子反应方程式为ClO-+Cl-+2H+=Cl2↑+H2O,故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
(4)该反应转移电子为2e-,用双线桥法表示该氧化还原反应中电子转移的方向和数目为 ,
,
故答案为: .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移表示方法,题目难度不大.

练习册系列答案
相关题目
14.下列离子方程式正确的是( )
| A. | 稀硝酸与氢氧化钾溶液反应:H++OH-=H2O | |
| B. | 铝与稀盐酸反应:Al+2H+=Al3++H2↑ | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl- | |
| D. | 足量二氧化碳与澄清石灰水反应:CO2+2OH-=CO32-+H2O |
11.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 电解NaCl饱和溶液,可制得金属钠 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |
12.一定条件下,可逆反应:H2(g)+I2(g)?2HI(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
| A. | 混合气体的颜色不再改变 | B. | 混合气体的密度不再改变 | ||
| C. | 混合气体的压强不再改变 | D. | 混合气体的平均分子质量不再改变 |
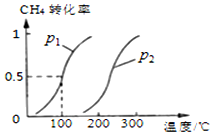 甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.
甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.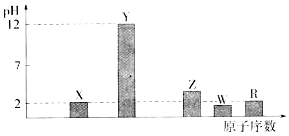
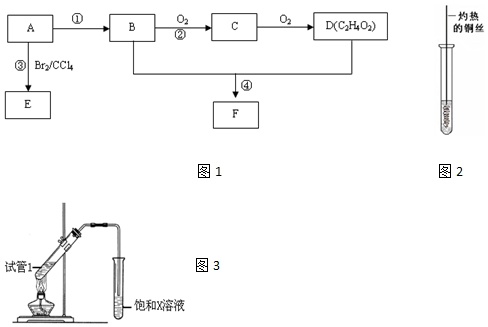
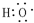 ,D中官能团为羧基(-COOH).
,D中官能团为羧基(-COOH). CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.