题目内容
3.如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.常温常压下D、F、K均为无色无刺激气味的气体,B是常见的无色液体,A是由单质C在D中燃烧产生的淡黄色的固体.(反应中部分生成物质己略去)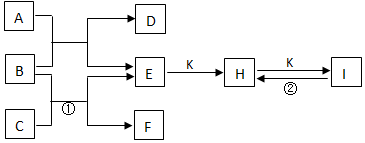
请回答下列问题:
(1)物质A的化学式为Na2O2.
(2)实验室C的保存方法保存在煤油中.
(3)反应①的离子方程式为2Na+2H2O═2Na++OH-+H2↑.
(4)反应②的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
分析 A是由单质C在D中燃烧生成的淡黄色固体,应为Na2O2,B是最常见的无色液体,应为H2O,则D为O2,E为NaOH,C为Na,F为H2,由转化关系可知K为CO2,H为Na2CO3,I为NaHCO3,结合物质的性质和题目的要求可解答该题.
解答 解:A是由单质C在D中燃烧生成的淡黄色固体,应为Na2O2,B是最常见的无色液体,应为H2O,则D为O2,E为NaOH,C为Na,F为H2,由转化关系可知K为CO2,H为Na2CO3,I为NaHCO3,
(1)由以上分析可知A为Na2O2,故答案为:Na2O2;
(2)C为Na为活泼金属,易和水、氧气等物质发生反应,需要隔离空气,钠保存在煤油中,
故答案为:保存在煤油中;
(3)反应①为Na和H2O的反应,反应的离子方程式为2Na+2H2O═2Na++OH-+H2↑,
故答案为:2Na+2H2O═2Na++OH-+H2↑;
(4)反应②是酸式盐转化为正盐,反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
点评 本题考查无机物的推断,题目难度不大,本题注意意把握常见物质的颜色以及常见反应,为解答该题的关键,注意把握相关物质的性质,学习中注意积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列离子方程式正确的是( )
| A. | 稀硝酸与氢氧化钾溶液反应:H++OH-=H2O | |
| B. | 铝与稀盐酸反应:Al+2H+=Al3++H2↑ | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl- | |
| D. | 足量二氧化碳与澄清石灰水反应:CO2+2OH-=CO32-+H2O |
11.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 电解NaCl饱和溶液,可制得金属钠 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |
18.证明苯分子中不存在单双键交替的理由是( )
| A. | 苯的邻位二元取代物只有一种 | B. | 苯的间位二元取代物只有一种 | ||
| C. | 苯的对位二元取代物只有一种 | D. | 苯的邻位二元取代物有二种 |
8.在MnO2+4HCl═MnCl2+Cl2↑+2H2O 反应中氧化剂与还原剂分子数之比为( )
| A. | 1:4 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
12.一定条件下,可逆反应:H2(g)+I2(g)?2HI(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
| A. | 混合气体的颜色不再改变 | B. | 混合气体的密度不再改变 | ||
| C. | 混合气体的压强不再改变 | D. | 混合气体的平均分子质量不再改变 |