题目内容
已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F、M为中学常见的氧化物,E是磁铁矿的主要成分(是黑色固体);H、K为中学常见的盐;M是一种常见的无色液体.各物质间的转化关系如图所示(某些条件已略去).

请回答:
(1)物质H的化学式为 .
(2)由F与M作用生成G的化学反应基本类型为 .
(3)A与C在加热条件下反应的化学方程式为: .
(4)G的浓溶液在加热条件下能跟C反应,该反应中G体现了 (填序号).
A.氧化性 B.还原性 C.漂白性 D.酸性
(5)若先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为 .
(6)H溶液在空气中长期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因: .

请回答:
(1)物质H的化学式为
(2)由F与M作用生成G的化学反应基本类型为
(3)A与C在加热条件下反应的化学方程式为:
(4)G的浓溶液在加热条件下能跟C反应,该反应中G体现了
A.氧化性 B.还原性 C.漂白性 D.酸性
(5)若先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为
(6)H溶液在空气中长期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因:
考点:无机物的推断
专题:推断题
分析:A为淡黄色固体单质,应为S,E是具有磁性的黑色晶体,应为Fe3O4,由B和A能连续反应可知B为O2,C为Fe,D为SO2,F为SO3,M为一种常见的无色液体,应为H2O,则G为H2SO4,由H和K的转化关系可知H为FeSO4,K为Fe3(SO4)2,结合对应物质的性质以及题目要求可解答该题.
解答:
解:A为淡黄色固体单质,应为S,E是具有磁性的黑色晶体,应为Fe3O4,由B和A能连续反应可知B为O2,C为Fe,D为SO2,F为SO3,M为一种常见的无色液体,应为H2O,则G为H2SO4,由H和K的转化关系可知H为FeSO4,K为Fe3(SO4)2,
(1)由以上分析可知H为FeSO4,故答案为:FeSO4;
(2)由F与M作用生成G的化学反应基本类型为化合反应,反应方程式为SO3+H2O=H2SO4,故答案为:化合反应;
(3)A与C在加热条件下反应的化学方程式为Fe+S
FeS,故答案为:Fe+S
FeS;
(4)铁与浓硫酸在加热条件下反应生成硫酸铁和二氧化硫气体,浓硫酸在反应中表现为强氧化性和酸性,故答案为:A D;
(5)二氧化硫与氯化钡不反应,通入氨气,溶液呈碱性,存在大量的亚硫酸根离子,可生成亚硫酸钡沉淀,故答案为:先无明显现象,通入NH3后产生白色沉淀;
(6)H为FeSO4,具有还原性,可与空气中氧气发生反应生成红褐色氢氧化铁沉淀,反应的离子方程式为4Fe2++O2+10H2O═4Fe(OH)3+8H+或4Fe2++8OH-+O2+2H2O═4Fe(OH)3,
故答案为:4Fe2++O2+10H2O═4Fe(OH)3+8H+或4Fe2++8OH-+O2+2H2O═4Fe(OH)3.
(1)由以上分析可知H为FeSO4,故答案为:FeSO4;
(2)由F与M作用生成G的化学反应基本类型为化合反应,反应方程式为SO3+H2O=H2SO4,故答案为:化合反应;
(3)A与C在加热条件下反应的化学方程式为Fe+S
| ||
| ||
(4)铁与浓硫酸在加热条件下反应生成硫酸铁和二氧化硫气体,浓硫酸在反应中表现为强氧化性和酸性,故答案为:A D;
(5)二氧化硫与氯化钡不反应,通入氨气,溶液呈碱性,存在大量的亚硫酸根离子,可生成亚硫酸钡沉淀,故答案为:先无明显现象,通入NH3后产生白色沉淀;
(6)H为FeSO4,具有还原性,可与空气中氧气发生反应生成红褐色氢氧化铁沉淀,反应的离子方程式为4Fe2++O2+10H2O═4Fe(OH)3+8H+或4Fe2++8OH-+O2+2H2O═4Fe(OH)3,
故答案为:4Fe2++O2+10H2O═4Fe(OH)3+8H+或4Fe2++8OH-+O2+2H2O═4Fe(OH)3.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和推断能力的考查,注重于元素化合物知识的综合运用,化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合可根据物质的特殊颜色或特殊化学反应,推断元素或化合物,注意“题眼”的确定,准确确定“题眼”是解推断题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、1L 0.1mol/L的碳酸钠溶液中C(Na+):C(CO32-)=2:1 |
| B、25℃时NaOH溶液中水的Kw大于100℃时NaCl溶液中水的Kw |
| C、中和体积相同pH相等的硫酸和醋酸溶液,消耗等物质的量浓度的NaOH溶液的体积:硫酸>醋酸 |
| D、25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(OH-)=10-6mol?L-1 |
下列叙述不正确的是( )
| A、与28 gCO具有相同分子数的C2H4的质量一定是28 g |
| B、1 molAl3+含有的核外电子数为3NA |
| C、常温常压下,1 molL甲烷含有的原子数为5NA |
| D、1 L 1 mol?L-1醋酸溶液中CH3COO+的数目小于NA |
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2气态分子;Y与M形成的气态化合物的相对分子质量为17,W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C、Z元素形成的某种单质有漂白性 |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
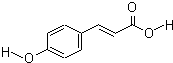 对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图:
对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图: 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.读氨氧燃料电池示意图,回答下列问题:
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.读氨氧燃料电池示意图,回答下列问题: