题目内容
17.已知有机物M: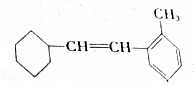 .
.(1)关于有机物M,下列说法正确的是abcd.
a.M可以与氯气发生取代反应
b.M可以与氯气发生加成反应
c.M在空气中燃烧时伴随着黑烟
d.M可以使酸性高锰酸钾溶液褪色
(2)1molM与溴的四氯化碳溶液混合,最多消耗Br2的物质的量为1mol.
(3)1molM和H2加最多消耗4molH2.
(4)1molM完全燃烧生成二氧化碳和水,共消耗20molO2.
分析 (1)该物质中含有苯环、碳碳双键和甲基,具有苯、烯烃、烷烃性质,能发生取代反应、加成反应、加聚反应;
(2)只有碳碳双键能和溴发生加成反应;
(3)碳碳双键和苯环在一定条件下都能和氢气发生加成反应;
(4)该物质分子式为C15H20,1molM完全燃烧生成二氧化碳和水耗氧量=(15+$\frac{20}{4}$)×1mol.
解答 解:(1)a.M可以与氯气在光照条件下发生取代反应生成氯代烃,故a正确;
b.含有碳碳双键,则一定条件下M可以与氯气发生加成反应,故b正确;
c.该物质分子式为C15H20,含碳量较高,则M在空气中燃烧时伴随着黑烟,故c正确;
d.含有碳碳双键,则M可以使酸性高锰酸钾溶液褪色,故d正确;
故选abcd;
(2)只有碳碳双键能和溴发生加成反应,1molM与溴的四氯化碳溶液混合,最多消耗Br2的物质的量为1mol,
故答案为:1;
(3)碳碳双键和苯环在一定条件下都能和氢气发生加成反应,则1molM和H2加最多消耗氢气4mol,故答案为:4;
(4)该物质分子式为C15H20,1molM完全燃烧生成二氧化碳和水耗氧量=(15+$\frac{20}{4}$)×1mol=20mol,
故答案为:20.
点评 本题考查有机物结构和性质,为高频考点,涉及烯烃性质、方程式的有关计算,侧重考查学生判断及计算能力,注意耗氧量的计算方法,题目难度不大.

练习册系列答案
相关题目
8.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 100mL1mol/LNa2CO3溶液中含有0.1NA个CO32- | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g | |
| C. | 1molCl2与过量Fe反应,转移的电子数为2 NA | |
| D. | 标准状况下,11.2L乙醇完全燃烧产生二氧化碳分子数为NA |
5.下列关于元素周期表和元素周期律的说法中正确的是( )
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次增大 | |
| D. | 第ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点升高 |
12.在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1、c(B)=0.200mol•L-1及c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )

| A. | 0min时,三个实验的瞬间速率相同 | |
| B. | 不考虑温度影响,10min时,实验③的瞬间速率最快 | |
| C. | 0~20min内,实验①、②化学平均速率相等 | |
| D. | 实验①、②相比,实验②可能加了催化剂 |
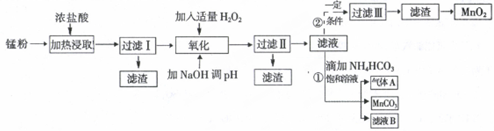
5.面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锌粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
根据以上信息回答问题:
(1)过滤I得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤II后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/L H2C2O4 50.00mLMnO2完全溶解,并产生A气体,写出该反应的离子反应方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤I得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤II后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2中加入过量酸化的0.50mol/L H2C2O4 50.00mLMnO2完全溶解,并产生A气体,写出该反应的离子反应方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/LKMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).
12.下列物质所属的类别及其所含官能团的对应关系不正确的是( )
| A. | CH3CH=CH2 烯烃 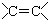 | B. | 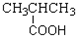 羧酸-COOH 羧酸-COOH | ||
| C. | 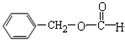 醛类 醛类 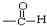 | D. | RCH2OH (R为烃基) 醇类-OH |
10.CH3COOH分子中-CH3及-COOH中碳原子的杂化类型分别是( )
| A. | sp3、sp2 | B. | sp3、sp | C. | sp2、sp | D. | sp2、sp3 |