题目内容
7.硫是一种在自然界分布较广的元素,试根据所学知识回答下列问题.(1)单质硫可以从它的天然矿床或硫化物中制得,从黄铁矿(主要成分为FeS2)中提取硫时,可将矿石和焦炭的混合物放在炼硫炉,在有限的空气中燃烧,即可分离出硫:
3FeS2+12C+8O2=1 Fe3O4+12CO+6S
①已知该反应中O2得电子总数有3/4来自于C,试配平上述化学方程式;
②若某黄铁矿矿石中FeS2的质量分数为a%,在炼焦炉中硫的损失率为b%,则m吨上述矿石可制得m×a%×$\frac{64}{120}$(1-b%)吨硫.
(2)通常情况下,硫单质常以S8分子形式存在,试写出S8在充足的空气中燃烧的化学方程式:S8+8O2$\frac{\underline{\;点燃\;}}{\;}$8SO2.
(3)硫代硫酸钠晶体(Na2S2O3•5H2O),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:S2O32-+2H+=S↓+SO2↑+H2O;
(4)过二硫酸是一种具有极强氧化性的硫的含氧酸:
①电解硫酸和硫酸铵的混合溶液,可制得过二硫酸盐,总反应为:2H++2SO42-$\frac{\underline{\;电解\;}}{\;}$S2O82-+H2↑,其阳极反应方程式为:2SO42--2e-=S2O82-;
②过硫酸盐在Ag+催化作用下能将Mn2+氧化成MnO4-,而S2O82-则被还原成SO42-,1mol S2O82-氧化Mn2+可制得0.4mol MnO4-.
分析 (1)①FeS2中$\frac{2}{3}$的+2价Fe变为+3价Fe,-1价S变为0价,C由0价变为+2价,O由0价变为-2价,因此一个FeS2化合价升高$\frac{8}{3}$价,一个C化合价升高2价,一个O2化合价降低4价,O2得电子总数有3/4来自于C可知C与O2的化学计量数之比为3:2,FeS2的化学计量数为$\frac{3}{4}$,然后根据原子守恒配平并使化学计量数为正整数;
②根据硫元素的质量守恒进行计算;
(2)S8在充足的空气中燃烧生成二氧化硫;
(3)生成淡黄色沉淀是S,放出的气体能使品红溶液褪色,该气体是二氧化硫,写出反应物离子和生成物,然后配平;
(4)①在电解池中,阳极上发生氧化反应,SO42-在阳极放电生成S2O82-;
②Mn2+~MnO4-,化合价升高5,S2O82-~2SO42-,化合价降低2×1,根据得失电子守恒计算.
解答 解:(1)①FeS2中$\frac{2}{3}$的+2价Fe变为+3价Fe,-1价S变为0价,C由0价变为+2价,O由0价变为-2价,因此一个FeS2化合价升高$\frac{8}{3}$价,一个C化合价升高2价,一个O2化合价降低4价.由O2得电子总数有3/4来自于C,可知C与O2的化学计量数之比为3:2,假定C的化学计量数为3,O2的化学计量数为2,则FeS2的化学计量数为$\frac{4×2×(1-\frac{3}{4})}{\frac{8}{3}}$=$\frac{3}{4}$,然后化学计量数均扩大四倍,根据原子守恒可得3FeS2+12C+8O2═Fe3O4+12CO+6S,
故答案为:3;12;8;1;12;6;
②m吨黄铁矿中含有硫元素的质量为m×a%×$\frac{64}{120}$吨,在炼焦炉中硫的损失后剩余m×a%×$\frac{64}{120}$(1-b%)吨,
故答案为:m×a%×$\frac{64}{120}$(1-b%);
(2)S8在充足的空气中燃烧生成二氧化硫,化学方程式为S8+8O2$\frac{\underline{\;点燃\;}}{\;}$8SO2,
故答案为:S8+8O2$\frac{\underline{\;点燃\;}}{\;}$8SO2;
(3)硫代硫酸钠晶体遇酸反应生成淡黄色沉淀是S,放出的气体能使品红溶液褪色,该气体是二氧化硫,离子方程式为S2O32-+2H+=S↓+SO2↑+H2O,
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(4)①在电解池中,阳极上发生氧化反应,SO42-在阳极放电生成S2O82-,因此阳极电极反应式为2SO42--2e-=S2O82-,
故答案为:2SO42--2e-=S2O82-;
②Mn2+~MnO4-,Mn化合价升高5,S2O82-~2SO42-,一个S2O82-中S的合价共降低2×1,设1mol S2O82-氧化Mn2+可制得x mol MnO4-,根据得失电子守恒,
1mol×2=5×x mol,解得x=0.4,
故答案为:0.4.
点评 本题考查了氧化还原反应的应用,综合性很强,题目难度很大,涉及氧化还原反应的配平、依据得失电子相等的计算、方程式的书写等问题,其中(1)配平难度较大.

| A. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 常温常压下,8.0g CH4中含有的价电子总数为5NA | |
| C. | 在标准状况下,22.4 L CH4与NH3混合气所含有的质子总数为10NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
| A. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率为“1 mol/(L•min)”表示的意思是:时间为1 min 时,某物质的浓度为1 mol/L | |
| D. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 |
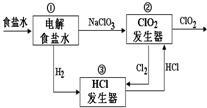 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.装置①中的反应:NaCl+3H2O$\stackrel{通直流电}{→}$NaClO3+3H2↑
装置②中的反应:2NaClO3+4HCl→2ClO2+Cl2↑+2NaCl+2H2O
下列关于该流程的说法正确的是( )
| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |
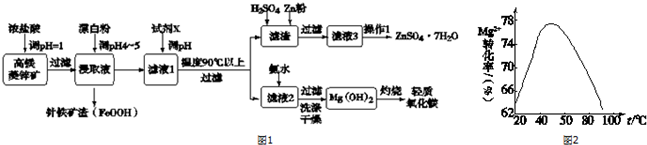
已知:金属离子沉淀的pH
| Zn2+ | Mg2+ | Cu2+ | Fe3+ | Fe2+ | |
| 开始沉淀pH | 5.9 | 9.4 | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 8.2 | 12.4 | 6.7 | 3.7 | 9.6 |
(2)下列说法正确的是acd.
a.用浓盐酸浸取前,将矿石粉碎能够提高浸出速率.
b.试剂X可以选择氨水,pH的范围在8.2~12.4之间.
c.控制温度在90℃以上的目的是为了促进Zn2+的水解.
d.滤渣中加入硫酸后再加入锌粉是为了出去Cu2+.
(3)由Fe2+生成针铁矿渣的离子反应方程式2Fe2++ClO-+3H2O=2FeOOH+Cl-+4H+.
(4)从滤液3中获取ZnSO4•7H2O的操作1是加热浓缩、冷却结晶、过滤、洗涤、干燥.
(5)加入氨水制备氢氧化镁的工艺过程要选择适宜条件.图2为反应温度与Mg2+转化率的关系.
①根据图中所示45℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”)反应.
②50℃以上温度升高,Mg2+转化率下降的原因可能是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
③为了获取副产品CaCl2,经常用石灰乳代替氨水来制备氢氧化镁.用平衡移动原理解释石灰乳能够制备氢氧化镁的原因石灰乳中存在Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),Mg2+可以与OH-反应生成更难溶的Mg(OH)2,使得OH-浓度不断下降,平衡右移,最终从Ca(OH)2转化为Mg(OH)2.
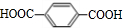 +2NaHCO3→
+2NaHCO3→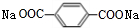 +2H2O+2CO2↑.
+2H2O+2CO2↑.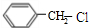 .
.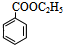 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$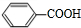 +CH3CH2OH.
+CH3CH2OH.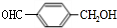 ,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n
,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$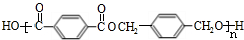 +(2n-1)H2O.
+(2n-1)H2O.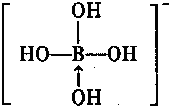 .(若存在配位键需标出)
.(若存在配位键需标出)
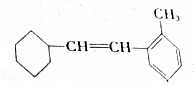 .
.