题目内容
4.把CoCl2•6H2O和碳酸铵混合氧化,然后加入盐酸可得到化合物A(化学式为CoCl3H12N4),在A中加入硝酸银溶液只有$\frac{1}{3}$的氯可被沉淀.A的结构式为[Co(NH3)4Cl2]Cl.根据价层电子对互斥理论,推测CO32-的空间构型为正三角形.分析 配合物中內界原子不能发生电离,外界离子在水溶液里能发生电离,氯离子可以与银离子反应生成氯化银白色沉淀,根据沉淀情况可以得到有几个离子在配合物中,根据元素守恒及配合物的特点,确定化学式;根据CO32-的中心原子价电子对数确定离子的空间构型,价层电子对个数=σ键个数+孤电子对个数.
解答 解:在A中加入硝酸银溶液只有$\frac{1}{3}$的氯可被沉淀,说明在反应生成物中有$\frac{1}{3}$的氯在配合物的外界,又因为A的化学式为CoCl3H12N4,其中有氨分子和$\frac{2}{3}$的氯离子做配体,根据元素守恒及配合物的特点,可推知A的结构式为[Co(NH3)4Cl2]Cl;在CO32-的中孤对电子$\frac{4+2-3×2}{2}$=0,价层电子对个数=3+0=3,所以C按sp2方式杂化,其空间构型为正三角形,
故答案为:[Co(NH3)4Cl2]Cl; 正三角形.
点评 本题考查配合物和微粒的空间构型判断,注意配合物内界与外界区别:配合物中外界离子在水溶液里能发生电离,內界原子不能发生电离以及掌握价层电子对互斥理论的应用是解答关键,题目难度中等.

练习册系列答案
相关题目
14.如表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)请写出j原子外围电子排布式3d74s2.
(2)c、d原子半径大小c>d,第一电离能大小关系是c>d,
电负性大小关系是c<d.(以上填“>”或“<”)
(3)j元素在元素周期表中位于四周期Ⅷ族,又已知NH3•H2O的电离方程式为NH3•H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3•H2O的合理结构是b (填序号,见图).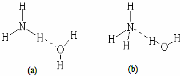
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ•mol-):
表中X、Y可能分别为以上元素中的Na、Al(填写元素符号).
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为1;该元素与元素a形成的分子X的空间构型为三角锥形.
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
(2)c、d原子半径大小c>d,第一电离能大小关系是c>d,
电负性大小关系是c<d.(以上填“>”或“<”)
(3)j元素在元素周期表中位于四周期Ⅷ族,又已知NH3•H2O的电离方程式为NH3•H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3•H2O的合理结构是b (填序号,见图).

(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ•mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为1;该元素与元素a形成的分子X的空间构型为三角锥形.
15.如表是元素周期表的一部分,回答下列问题:
请用这十二种元素回答下列问题:
(1)写出①元素的名称碳.
(2)金属性最强的元素是Na(填元素符号).
(3)元素⑩形成的两种氧化物中,能使品红溶液褪色的是SO2(填化学式).
(4)写出元素④和元素⑥形成的化合物的电子式 .
.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(1)写出①元素的名称碳.
(2)金属性最强的元素是Na(填元素符号).
(3)元素⑩形成的两种氧化物中,能使品红溶液褪色的是SO2(填化学式).
(4)写出元素④和元素⑥形成的化合物的电子式
 .
.
19.某钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、NO3-等阴离子.某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀完全溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
则下列说法不正确的是( )
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀完全溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
则下列说法不正确的是( )
| A. | 根据②③④可确定一定含有NO2-、CO32-、Cl-三种阴离子 | |
| B. | 由②中的实验现象可推测一定含有NO2- | |
| C. | 不能确定是否一定含有NO3- | |
| D. | 由④即可确定一定不存在SO42-、SO32- |
9.下列叙述正确的是( )
| A. | 氯化钠的电离是指在电流作用下离解成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物都是酸 | |
| C. | 硫酸钡难溶于水,所以硫酸钡属于弱电解质 | |
| D. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 |
13.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.
下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分)

(2)B元素处于周期表中第三周期第ⅢA族.
(3)C、D的简单离子的半径由大到小顺序为S2->Cl-(填离子符号).
(4)上述五种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(5)C、E形成的化合物为SO2、SO3(填化学式).
下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |

(2)B元素处于周期表中第三周期第ⅢA族.
(3)C、D的简单离子的半径由大到小顺序为S2->Cl-(填离子符号).
(4)上述五种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(5)C、E形成的化合物为SO2、SO3(填化学式).
14. 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )| A. | 反应消耗镁、铝的物质的量之比是3:2 | |
| B. | 反应消耗镁、铝的质量之比是3:2 | |
| C. | 与镁和铝反应的硫酸的物质的量之比是3:2 | |
| D. | 与镁和铝反应的硫酸的质量之比是3:2 |




