题目内容
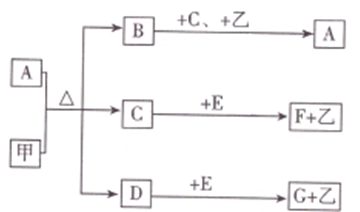
5.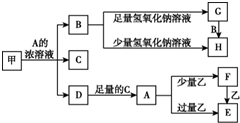 中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).请回答下列问题:
(1)G的名称为碳酸钠;F的化学式为Fe(NO3)3.
(2)写出甲与A的浓溶液反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(3)除去G固体中含有H的杂质采用的方法是加热.
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(5)写出由F转化为E的离子方程式2Fe3++Fe=3Fe2+.将溶液F加热蒸干、灼烧到质量不再减少时所得固体物质的化学式为Fe2O3.
分析 D是红棕色气体,说明D是NO2,甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,D与C反应得到A,则B是CO2,C是H2O.二氧化碳和足量氢氧化钠溶液反应生成碳酸钠和水,而二氧化碳和少量氢氧化钠溶液反应生成碳酸氢钠和水,所以G是碳酸钠,而H是碳酸氢钠.乙是生活中常见的金属单质,硝酸和少量乙反应生成F,和过量乙反应生成E,F和乙又可生成E,可知乙为金属铁,而F为硝酸铁,E为硝酸亚铁.
解答 解:D是红棕色气体,说明D是NO2,甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,D与C反应得到A,则B是CO2,C是H2O.二氧化碳和足量氢氧化钠溶液反应生成碳酸钠和水,而二氧化碳和少量氢氧化钠溶液反应生成碳酸氢钠和水,所以G是碳酸钠,而H是碳酸氢钠.乙是生活中常见的金属单质,硝酸和少量乙反应生成F,和过量乙反应生成E,F和乙又可生成E,可知乙为金属铁,而F为硝酸铁,E为硝酸亚铁.
(1)G的名称为碳酸钠,F的化学式为Fe(NO3)3,
故答案为:碳酸钠;Fe(NO3)3;
(2)甲与A的浓溶液反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)碳酸氢钠加热分解为碳酸钠,除去G(碳酸钠)固体中含有H(碳酸氢钠)的杂质采用的方法是加热,
故答案为:加热;
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐硝酸铵,该盐的溶液呈酸性,其原因是:NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
(5)由硝酸铁转化为硝酸亚铁的离子方程式:2Fe3++Fe=3Fe2+,硝酸铁溶液加热,促进铁离子水解彻底进行,得到氢氧化铁彻底,灼烧时氢氧化铁分解,最终所得固体物质的化学式为:Fe2O3,
故答案为:2Fe3++Fe=3Fe2=; Fe2O3.
点评 本题考查无机物的推断,物质的颜色及转化中特殊反应为推断突破口,熟练掌握元素化合物的性质.

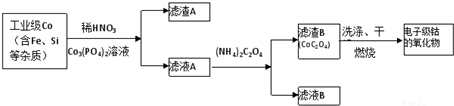
(1)滤渣A的成分除过量的Co的磷酸盐和Fe(OH)3外还有Si(填化学式).
(2)加入CO3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成 Co2+的离子方程式为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图1,写出C点物质的化学式:Co3O4
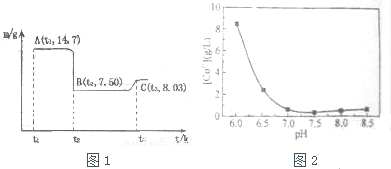
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1mol/L计算)
| 开始沉淀的pH | 完全溶解的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
由钴渣酸浸液制备氧化钴的实验步骤依次为:
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pHpH(5.0,7.2),使Fe3+、Al3+沉淀完全;
②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;
④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;
⑤400℃焙烧3h,得产品氧化钴.
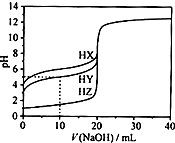 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的酸性强弱顺序:HZ<HY<HX | |
| B. | HZ、HY、HX均为弱酸 | |
| C. | 向HY溶液中加入10.00mLNaOH溶液,一定有c(Y-)+c(OH-)═c(H+)+c(Na+) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的三倍 |
| Z | Z的基态原子价电子排布为nsn-1 |
| W | W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
(2)与Z同周期且依次相邻的两种元素的原子与Z比较,三者第一电离能的大小顺序为I1(Mg)>I1(Al)>I1(Na)[用I1(元素符号)表示];Y的氢化物在同族的氢化物中沸点反常,其原因是水分子间存在氢键.
(3)写出W的单质在潮湿的空气中生成绿色锈斑的化学方程式,并标出电子转移的方向和数目:
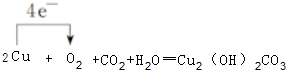 .
.(4)在X、Y与氢三种元素组成的多种分子中,有些分子的核磁共振氢谱显示有三种氢,且数目比为1:2:3,写出其中一种分子的名称:乙醇.X、Y可以形成多种弱酸根离子,写出其中一种离子水解的离子方程式:CO32-+H2O??HCO3-+OH-.
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3NA电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| A. | 42g乙烯和丙烯的混合气体中碳原子数目一定为3NA. | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入 0.1 mol Cu(OH)2能使溶液复原,则电解时产生标准状况下1.12L的气体 | |
| C. | 配制一定物质的量浓度的NaOH溶液,把NaOH固体于烧杯中充分溶解,并迅速转移到容量瓶中定容 | |
| D. | 30g的NO与O2于密闭容器中充分反应,容器内的气体分子数为1 NA. |
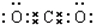 .
.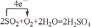 .
.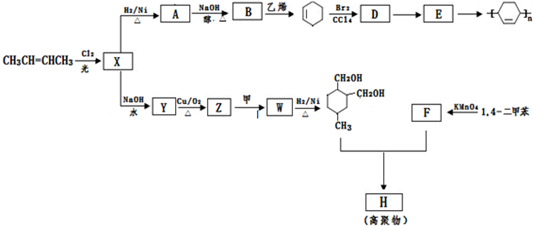
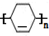
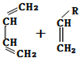 →
→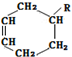 (或写成
(或写成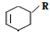 R代表取代基或氢)
R代表取代基或氢)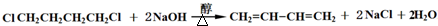 ;
;
 ;
;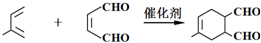 .
.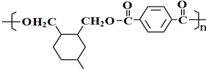 .
. .
. HSO3-+OH-(用离子方程式表示).
HSO3-+OH-(用离子方程式表示).