题目内容
13.X、Y、Z、W是元素周期表中前四周期原子序数依次增大的四种元素,其相关信息如表:| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的三倍 |
| Z | Z的基态原子价电子排布为nsn-1 |
| W | W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
(2)与Z同周期且依次相邻的两种元素的原子与Z比较,三者第一电离能的大小顺序为I1(Mg)>I1(Al)>I1(Na)[用I1(元素符号)表示];Y的氢化物在同族的氢化物中沸点反常,其原因是水分子间存在氢键.
(3)写出W的单质在潮湿的空气中生成绿色锈斑的化学方程式,并标出电子转移的方向和数目:
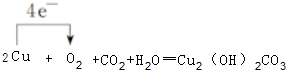 .
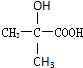
.(4)在X、Y与氢三种元素组成的多种分子中,有些分子的核磁共振氢谱显示有三种氢,且数目比为1:2:3,写出其中一种分子的名称:乙醇.X、Y可以形成多种弱酸根离子,写出其中一种离子水解的离子方程式:CO32-+H2O??HCO3-+OH-.
分析 X的基态原子核外只有三个能级,且各能级电子相等,原子核外的分子排布式为1s22s22p2,故X为C元素;Y的基态原子最外层电子数是其内层电子总数的三倍,最外层电子数不超过8,故原子只能有2个电子层,最外层电子数为6,则Y为O元素;Z的基态原子价电子排布为nsn-1,则Z为Mg;W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑,则W为Cu.
解答 解:X的基态原子核外只有三个能级,且各能级电子相等,原子核外的分子排布式为1s22s22p2,故X为C元素;Y的基态原子最外层电子数是其内层电子总数的三倍,最外层电子数不超过8,故原子只能有2个电子层,最外层电子数为6,则Y为O元素;Z的基态原子价电子排布为nsn-1,则Z为Mg;W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑,则W为Cu.
(1)W为Cu元素,处于周期表中第四周期IB族,外围电子排布式为3d104s1,4s能级1个电子为未成对电子,
故答案为:四、IB;1;
(2)与Z同周期且依次相邻的两种元素分别为Na和Al,同周期元素第一电离能从左到右有增大的趋势,但当外围电子在能量相等的轨道上形成全空、半满或全满结构时,原子的能量较低,元素的第一电离能较大,故I1(Mg)>I1(Al)>I1(Na),
Y的氢化物为H2O,因为水分子间存在氢键,所以沸点反常,高于同族氢化物的沸点,
故答案为:I1(Mg)>I1(Al)>I1(Na);水分子间存在氢键;
(3)W单质生成绿色锈斑,是铜与空气中CO2、H2O、O2反应生成Cu2(OH)2CO3,电子转移由铜指向氧,标出电子转移的方向和数目: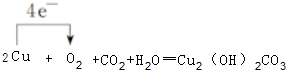 ,
,
故答案就为: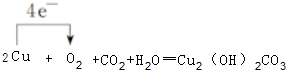 ;
;
(4)由C、H、O三种元素组成的有机物,分子的核磁共振氢谱显示有三种氢,且数目比为1:2:3,符合题给条件要求的为乙醇;C、O可以组成多种弱酸根离子,如CO32-、C2O42-等,其中一种离子水解的离子方程式:CO32-+H2O??HCO3-+OH-,
故答案为:乙醇;CO32-+H2O??HCO3-+OH-.
点评 本题考查原子结构、电离能、羟基、电子转移、元素化合物知识等,根据核外电子排布推断元素是解题关键,注意同周期主族元素中第一电离能异常情况、氢键对物质性质的影响.

 名校课堂系列答案
名校课堂系列答案| A. | 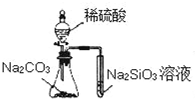 实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 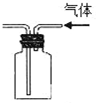 实验装置排空气法收集CO2气体 | |
| C. | 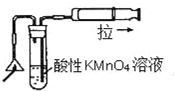 可以检验火柴燃烧生成的SO2气体 | |
| D. | 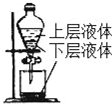 提取海带中的碘 |

 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.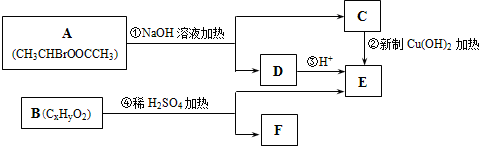
 .
. 、
、 、
、 、
、 任意1种.
任意1种. 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.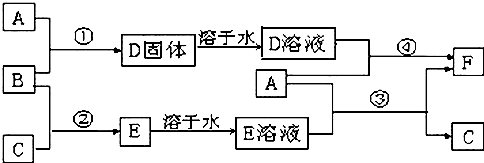
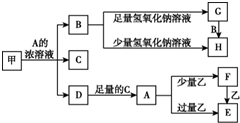 中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).
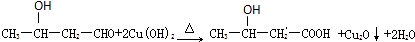 .
.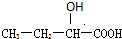 、
、 .
.