题目内容
15.电子级钴氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物,其工业制取流程如下: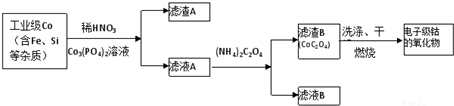
(1)滤渣A的成分除过量的Co的磷酸盐和Fe(OH)3外还有Si(填化学式).
(2)加入CO3(PO4)2的目的是调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀.
(3)Co与稀硝酸反应生成 Co2+的离子方程式为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑.
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如图1,写出C点物质的化学式:Co3O4
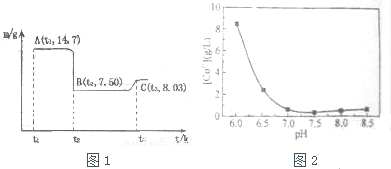
(5)上述制备过程中采用草酸盐作为沉淀剂,由于生产成本较高,某科研小组研究从钴渣酸浸液(主要成分为CoSO4、Fe2(SO4)3、Al2(SO4)3)出发,以碳铵(NH4HCO3)代替草酸盐作沉淀剂,并由此制备氧化钴.请结合相关信息,补充完整实验步骤.
已知:a.金属离子生成氢氧化物沉淀pH如下表(开始沉淀pH按金属离子1mol/L计算)
| 开始沉淀的pH | 完全溶解的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
由钴渣酸浸液制备氧化钴的实验步骤依次为:
①往钴渣酸浸液中滴加NaOH溶液,调节溶液pHpH(5.0,7.2),使Fe3+、Al3+沉淀完全;
②过滤;③配制一定浓度的碳铵溶液,缓慢加入到滤液中,搅拌,控制pH至7.0左右,使Co2+沉淀完全,过滤;
④将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;
⑤400℃焙烧3h,得产品氧化钴.
分析 工业级Co加入稀硝酸和磷酸钴,得到滤渣A含有CoSO4、Fe(OH)3、Si,滤液B含有Co2+,加入草酸铵生成CoC2O4,经洗涤、干燥、灼烧得到氧化钴,
(1)硅和硝酸不反应;
(2)铁离子以水解,加入Co3(PO4)2可调节溶液pH,使铁离子全部沉淀;
(3)Co和硝酸发生氧化还原反应;
(4)A为CoC2O4,n(CoC2O4)=$\frac{14.7g}{147g/mol}$=0.1mol,m(Co)=0.1mol×59g/mol=5.9g,C点氧化物的质量为8.03g,则n(O)=$\frac{8.03g-5.9g}{16g/mol}$=1.33,以此计算;
(5)由表中数据可知,应先加入氢氧化钠除去Fe3+、Al3+,可调节pH5.0~7.2之间,然后过滤,在滤液中加入一定浓度的碳铵溶液,控制pH至7.0左右,使Co2+沉淀完全,过滤,将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;最后加热400℃焙烧3h,得产品氧化钴.
解答 解:工业级Co加入稀硝酸和磷酸钴,得到滤渣A含有CoSO4、Fe(OH)3、Si,滤液B含有Co2+,加入草酸铵生成CoC2O4,经洗涤、干燥、灼烧得到氧化钴,
(1)硅和硝酸不反应,滤渣A含有CoSO4、Fe(OH)3、Si,
故答案为:Si;
(2)铁离子以水解,加入Co3(PO4)2可调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀,
故答案为:调节溶液pH,保证Co2+不沉淀,而使铁离子全部沉淀;
(3)Co和硝酸发生氧化还原反应,反应的离子方程式为3Co+8H++2NO3-═3Co2++4H2O+2NO↑,
故答案为:3Co+8H++2NO3-═3Co2++4H2O+2NO↑;
(4)A为CoC2O4,n(CoC2O4)=$\frac{14.7g}{147g/mol}$=0.1mol,m(Co)=0.1mol×59g/mol=5.9g,C点氧化物的质量为8.03g,则n(O)=$\frac{8.03g-5.9g}{16g/mol}$=1.33,则化学式为Co3O4,
故答案为:Co3O4;
(5)由表中数据可知,应先加入氢氧化钠除去Fe3+、Al3+,可调节pH5.0~7.2之间,然后过滤,在滤液中加入一定浓度的碳铵溶液,控制pH至7.0左右,使Co2+沉淀完全,过滤,将蒸馏水加热至70℃以上,洗涤CoCO3沉淀3次,干燥;最后加热400℃焙烧3h,得产品氧化钴,
故答案为:①pH(5.0,7.2),Fe3+、Al3+;③控制pH至7.0左右,使Co2+沉淀完全,过滤.
点评 本题考查了物质提纯和分离的工业制备流程分析判断,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,把握实验过程的分析应用,主要是物质性质的理解应用,题目难度较大.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| 类别 组合 | 酸性 氧化物 | 碱性 氧化物 | 电解质 | 强电解质 | 高分子 物质 |
| A | CO2 | CuO | 氨气 | NH3•H2O | 葡萄糖 |
| B | SO3 | Na2O | 稀硫酸 | NaOH | 果糖 |
| C | SO2 | CaO | 冰醋酸 | KOH | 纤维素 |
| D | N2O5 | Na2O2 | α-丙氨酸 | Cu(OH)2 | 聚乙烯 |
| A. | A | B. | B | C. | C | D. | D |
 ,B的结构简式
,B的结构简式 或
或 ;
;
 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-. 碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如图),每个碳原子通过sp2杂化与周围碳原子成键.
碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如图),每个碳原子通过sp2杂化与周围碳原子成键.
 .
. 、
、 、
、 、
、 任意1种.
任意1种.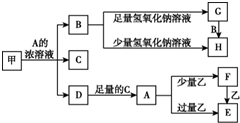 中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).