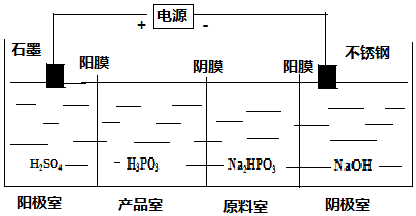
题目内容
13.有下列几种方法制备O2:(1)KClO3和MnO2共热,(2)H2O2中加MnO2,(3)KMnO4受热分解,若要制相同质量的O2,则上述反应中相关物质转移的电子数之比为( )| A. | 3:2:4 | B. | 1:1:1 | C. | 2:1:2 | D. | 1:2:1 |
分析 氯酸钾分解反应的方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{\;}$2KCl+3O2↑,转移电子是12mol,2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,转移电子是2mol,加热高锰酸钾的方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,转移电子是4mol,根据转移电子的数目和获得氧气的量进行计算
解答 解:氯酸钾分解反应的方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{\;}$2KCl+3O2↑,转移电子是12mol,2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,转移电子是2mol,加热高锰酸钾的方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,转移电子是4mol,当获得氧气常温常压下相同体积时,假设是1mol时,转移电子数分别是4mol、2mol、4mol,所以所转移的电子数目之比是2:1:2.
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子转移计算及分析能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列数据不一定随着温度升高而增大的是( )
| A. | 化学反应速率v | B. | 化学平衡常数K | ||
| C. | 弱电解质的电离平衡常数K | D. | 水的离子积常数Kw |
1.下列说法中正确的是( )
| A. | 标准状况下,32 g O2占有的体积约为22.4 L | |
| B. | 氢气的摩尔质量是2g | |
| C. | 在标准状况下,22.4 L水的质量为18 g | |
| D. | 1molH2O的质量是18g/mol |
18.物质的量相等的Na、Mg、Al分别跟足量稀H2SO4反应,产生的氢气的物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:1 |
5.短周期主族元素W、X、Y和Z的原子序数依次增大.其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X是形成化合物种类最多的元素,Y的最简单氢化物与Cl2混合后产生白烟,Z元素无正化合价.根据以上叙述,下列说法中正确的是( )
| A. | 由W 与X 组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| B. | 以上四种元素的原子半径大小为W<X<Y<Z | |
| C. | Y的气态简单氢化物的稳定性比Z的强 | |
| D. | W、Y、Z三种元素可形成离子化合物 |
2.关于NaClO+CO2+H2O=NaHCO3+HClO 之所以能发生解释正解的是( )
| A. | 该反应不能发生,不符合复分解反应发生条件,无沉淀或气体或水,应该左右倒过来写 | |
| B. | 该反应是复分解反应,能发生的原因可能是碳酸酸性比HClO强,符合强酸制弱酸原理 | |
| C. | 该反应不是复分解反应是氧化还原反应,自然不能套用复分解反应条件或规律 | |
| D. | 该反应可能是NaHCO3难溶于水,正好符合复分解反应发生条件之一 |
3.下列反应属于取代反应的是( )
| A. | 由乙烯制取氯乙烷 | B. | 乙烷在空气中燃烧 | ||
| C. | 乙烷在光照下与氯气反应 | D. | 乙烯使酸性高锰酸钾溶液褪色 |
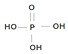 (为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为
(为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为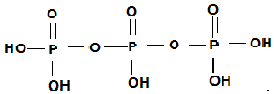 ;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.
;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.