题目内容
8.回答下列问题:(1)V L Fe2(SO4)3溶液中含Fe3+ m 克,则溶液中SO42-的物质的量浓度为$\frac{3m}{112V}$mol•L-1
(2)在无土栽培中,配制1L内含5mol NH4Cl、1.6mol KCl、2.4mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为6.4mol、0.2mol.
(3)相同条件下,某Cl2与O2混合气体100ml恰好与150mlH2化合成HCl和H2O,则混合气体中Cl2与O2的体积比为1:1.
(4)在同温、同压下,实验测得CO和O2的混合气体的密度是H2 的15倍,混合气体中CO和O2的物质的量之比为1:1.
分析 (1)根据n=$\frac{m}{M}$计算出mg铁离子的物质的量,再根据硫酸铁的化学式计算出硫酸根离子的物质的量,最后根据c=$\frac{n}{V}$计算出溶液中硫酸根离子的浓度;
(2)配制的溶液中的钾离子完全来自氯化钾,根据氯化钾、硫酸钾的物质的量可确定氯化钾的物质的量,氯离子来自氯化钾和氯化铵,根据氯离子守恒可计算出需要氯化铵的物质的量;
(3)由于氯气能与氢气化合生成了氯化氢,氧气与氢气化合生成了水,设与氯气的气体为X,则氧气的体积为(100mL-x),根据方程式表示出各自消耗氢气的体积,结合消耗氢气总体积列方程计算,相同条件下体积之比等于物质的量之比;
(4)同温同压下气体密度之比等于其摩尔质量之比,则混合气体平均相对分子质量为15×2=30,依据摩尔质量公式M=$\frac{m}{n}$计算.
解答 解:(1)VLFe2(SO4)3溶液中含Fe3+mg,含有铁离子的物质的量为:$\frac{mg}{56g/mol}$=$\frac{m}{56}$mol,溶液中含有硫酸根离子的物质的量为:$\frac{m}{56}$mol×$\frac{3}{2}$=$\frac{3m}{112}$mol,则溶液中SO42-的物质的量浓度为:$\frac{\frac{3m}{112}mol}{VL}$=$\frac{3m}{112V}$mol/L,
故答案为:$\frac{3m}{112V}$;
(2)在无土栽培中,配制1L内含5molNH4Cl、1.6molKCl、2.4molK2SO4的某营养液,该培养液中含有钾离子的总物质的量为:1.6mol+2.4mol×2=6.4mol,根据钾离子守恒,需要氯化钾的物质的量为6.4mol;需要配制的溶液中含有氯离子的物质的量为:5mol+1.6mol=6.6mol,其中6.4mol氯化钾中提供了6.4mol氯离子,则还需要氯化铵的物质的量为:6.6mol-6.4mol=0.2mol,
故答案为:6.4mol;0.2mol;
(3)设氯气的气体为x,氧气的体积为(100mL-x),则:
Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl 2H2 +O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
x x 2 (100mL-x) (100mL-x)
则:x+2(100mL-x)=150mL 解得:x=50mL,氧气的体积为:100mL-50mL=50mL,所以混合气体中Cl2和O2的体积之比为50mL:50mL=1:1,
故答案为:1:1;
(4)同温同压下气体密度之比等于其摩尔质量之比,而实验测得CO和O2的混合气体的密度是H2 的15倍,则混合气体平均相对分子质量为:2×15=30,
设CO物质的量为xmol,氧气的物质的量为ymol,
则:$\frac{28x+32y}{x+y}$=30,整理可得x:y=1:1,
故答案为:1:1.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与其它物理量之间的转化关系为解答关键,试题知识点较多、计算量较大,充分考查了学生的分析、理解能力及化学计算能力.

 在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)?M2R4(g),加入1mol M2和2molR2,反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )
在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)?M2R4(g),加入1mol M2和2molR2,反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )| A. | M2既可能为固体,也可能为气体 | |
| B. | 达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2,则R2转化率不变 | |
| C. | 达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍 | |
| D. | 若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4,则新的平衡时气体的平均相对分子质量增大 |
| A. | KCl NaHSO4 KHCO3 | B. | Na2SO4 BaCl2 Na2CO3 | ||
| C. | NaHCO3 Ba(OH)2 NaHSO4 | D. | Ca(OH)2 Na2CO3 BaCl2 |
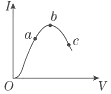 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为c<a<b
(2)a、b、c三点处,电离程度最大的是c
(3)表是几种常见弱酸的电离平衡常数(25℃):
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H | K=1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-H2CO3-?H++HCO32- | K1=4.31×10-7K2=5.61×10-11 |
| HClO | HClO?H++ClO- | K=3.0×10-8 |
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4H2SO4═2H++SO42-
②NH3•H2ONH3•H2O?NH4++OH-.
| A. | 将2.3 g Na投入到97.7 g水中充分反应,所得溶液的质量分数为4.0% | |
| B. | 相同质量的铝分别与足量的盐酸和NaOH溶液反应,生成气体物质的量之比为1:3 | |
| C. | 将CO2和H2O的混合气体a mol,与足量的Na2O2固体充分反应,生成的O2在标准状况下的体积为11.2a L | |
| D. | 120 mL含有0.20 mol碳酸钠的溶液与200 mL盐酸进行滴加反应,不管将前者滴入后者,还是后者滴入前者,滴加完全后,产生的气体在相同条件下体积不等,则盐酸的浓度可能为2 mol/L |
| A. | 3:2:4 | B. | 1:1:1 | C. | 2:1:2 | D. | 1:2:1 |
| A. | 干冰能用作冷冻剂 | |
| B. | 明矾可用作净水剂 | |
| C. | 味精可用作食品调味剂 | |
| D. | 苏打是一种膨松剂,可用于制作馒头和面包 |
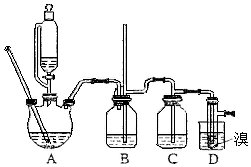 实验室制备1,2-二溴乙烷,用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:
实验室制备1,2-二溴乙烷,用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:有关数据列表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/0C | 78.5 | 132 | 34.6 |
| 熔点/0C | -130 | 9 | -116 |
| 溶解性 | 易溶水 | 难溶水 | 微溶于水 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是d(填正确选项前的字母;
a、引发反应 b、加快反应速度 c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收乙烯中的酸性杂质气体;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是防止倒吸、判断装置是否堵塞;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
(7)本实验中,1,2-二溴乙烷的产率为50%.