题目内容
5.短周期主族元素W、X、Y和Z的原子序数依次增大.其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X是形成化合物种类最多的元素,Y的最简单氢化物与Cl2混合后产生白烟,Z元素无正化合价.根据以上叙述,下列说法中正确的是( )| A. | 由W 与X 组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| B. | 以上四种元素的原子半径大小为W<X<Y<Z | |
| C. | Y的气态简单氢化物的稳定性比Z的强 | |
| D. | W、Y、Z三种元素可形成离子化合物 |
分析 短周期主族元素W、X、Y和Z的原子序数依次增大.X是形成化合物种类最多的元素,则X为C元素,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同,则W为H元素;Y的最简单氢化物与Cl2混合后产生白烟,Y为N元素,Z元素无正化合价,Z为O或F元素,以此来解答.
解答 解:由上述分析可知,W为H,X为C,Y为N,Z为O或F,
A.由W 与X 组成的化合物的沸点不一定低于由W与Y组成的化合物的沸点,烃的种类繁多,固态烃的沸点高于氨气的沸点,故A错误;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则以上四种元素的原子半径大小为W<Z<Y<X,故B错误;
C.非金属性Y<Z,则Y的气态简单氢化物的稳定性比Z的弱,故C错误;
D.W、Y、Z三种元素可形成离子化合物,如硝酸铵,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
19.一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成0.2mol Z.下列说法正确的是( )
| A. | 若将容器压缩时,正逆反应速率均不变 | |
| B. | 5 min内平均反应速率v(X)=0.02 mol/(L•min) | |
| C. | 向平衡后的体系中加入l molM(s),平衡向逆反应方向移动 | |
| D. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
16.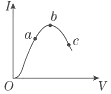 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为c<a<b
(2)a、b、c三点处,电离程度最大的是c
(3)表是几种常见弱酸的电离平衡常数(25℃):
CH3COOH、H2CO3、HClO,其中酸性最强的是CH3COOH,最弱的是HClO
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4H2SO4═2H++SO42-
②NH3•H2ONH3•H2O?NH4++OH-.
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为c<a<b
(2)a、b、c三点处,电离程度最大的是c
(3)表是几种常见弱酸的电离平衡常数(25℃):
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H | K=1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-H2CO3-?H++HCO32- | K1=4.31×10-7K2=5.61×10-11 |
| HClO | HClO?H++ClO- | K=3.0×10-8 |
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4H2SO4═2H++SO42-
②NH3•H2ONH3•H2O?NH4++OH-.
13.有下列几种方法制备O2:(1)KClO3和MnO2共热,(2)H2O2中加MnO2,(3)KMnO4受热分解,若要制相同质量的O2,则上述反应中相关物质转移的电子数之比为( )
| A. | 3:2:4 | B. | 1:1:1 | C. | 2:1:2 | D. | 1:2:1 |
17.下列关于常见化学物质的应用不正确的是( )
| A. | 干冰能用作冷冻剂 | |
| B. | 明矾可用作净水剂 | |
| C. | 味精可用作食品调味剂 | |
| D. | 苏打是一种膨松剂,可用于制作馒头和面包 |
14.常温下将pH=9的Ba(OH)2溶液稀释500倍,稀释溶液后,c (OH-)与c (Ba2+)的比值近似为( )
| A. | 1:1 | B. | 1:2 | C. | 10:1 | D. | 2:1 |
15.下列有关说法正确的是( )
| A. | HClO是弱酸,但NaClO强电解质 | |
| B. | HC1、SO2、HBr三种气体都可用浓硫酸干燥 | |
| C. | 向浓氨水中滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 | |
| D. | SO2和SO3都是酸性氧化物,两者的水溶液都是二元强酸 |