题目内容
14.某溶液中由水电离出来的C(H+)=10-12mol/L,则该溶液中能大量共存的离子组是( )| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、S2- | ||
| C. | NH4+、Mg2+、SO42-、NO3- | D. | H+、K+、Na+、Cl- |
分析 某溶液中由水电离出来的c(H+)=10-12mol/L,该溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,然后结合离子反应发生条件进行解答.
解答 解:由水电离出来的c(H+)=10-12mol/L,该溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,
A.碳酸氢根离子与氢离子、氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.硫离子与氢离子反应,在酸性溶液中不能大量共存,故B错误;
C.铵根离子、镁离子与氢氧根离子反应,在碱性溶液中不能大量共存,故C错误;
D.H+、K+、Na+、Cl-之间不发生反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
5.下列电离方程式不正确的是( )
| A. | NaHCO3═Na++HCO3- | B. | NaHSO4═Na++H++SO42- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43- |
9.下列现象与氢键有关的是( )
①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
④水分子高温下也很稳定
⑤水分子较硫化氢分子稳定.
①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
④水分子高温下也很稳定
⑤水分子较硫化氢分子稳定.
| A. | ①②③ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③④ |
19.X和Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是( )
| A. | X的金属性比Y的金属性强 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X 元素的氢氧化物碱性弱 | |
| D. | X元素的最高化合价比Y 元素的最高化合价高 |
6.设NA表示阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 标准状况下,2.24 L甲醛中含氧原子数目为0.1NA | |
| B. | 常温下,28g C2H4含NA个碳碳双键 | |
| C. | 常温常压下,1 mol羟基所含的电子数为9NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
3.以下对生活事实的解释,不正确的是( )
| A. | 厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解 | |
| B. | 用灼烧的方法可以区别人造丝和蚕丝,因为蚕丝是蛋白质,被灼热时会产生具有烧焦羽毛的气味 | |
| C. | 食品添加剂虽然能改善食物的色、香、味,但由于他们对健康有害,均不宜食用 | |
| D. | 高温消毒是通过加热的方法使细菌的蛋白质变性而死亡 |
4. 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:
S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的S2O32-或Na2S2O3耗尽后,溶液颜色将由无色变成为蓝色.其中该反应速率快慢的是由第一个(填“第一个”或“第二个”)反应决定的.为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2:1.
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中V3、V4和V5取实验设计的体积数值,目的是探究K2S2O8浓度对反应速率的影响,KI溶液、Na2S2O3溶液用量相等,表中的V2=2.0,理由是保证溶液总体积不变,即其他条件不变,只改变反应物K2S2O8浓度,从而才达到对照实验目的.
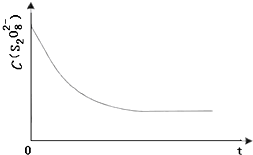
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度(曲线a)和加入催化剂(曲线b)时c(S2O82-)~t的变化曲线示意图.
 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的S2O32-或Na2S2O3耗尽后,溶液颜色将由无色变成为蓝色.其中该反应速率快慢的是由第一个(填“第一个”或“第二个”)反应决定的.为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2:1.
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积/mL溶液 | ||||
| K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | V1 | V3 | 4.0 | 2.0 |
| ③ | 8.0 | V2 | V4 | V5 | 2.0 |
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度(曲线a)和加入催化剂(曲线b)时c(S2O82-)~t的变化曲线示意图.
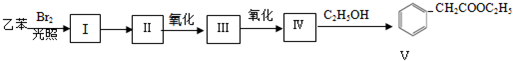
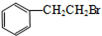 .
. .
.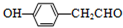 .
.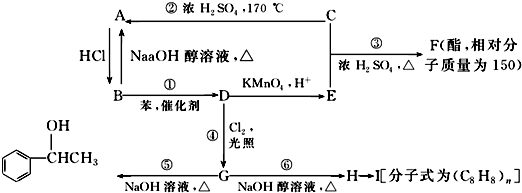
 ,E
,E .
.

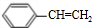 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.