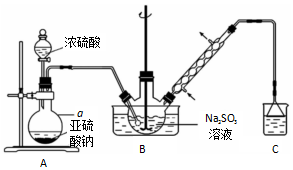
题目内容
16.下列各选项中的离子可大量共存的是( )| A. | H+、Na+、NO3-、CO32- | B. | Fe3+、K+、I-、SCN | ||
| C. | Al3-、Cu2+、SO42-、NO3- | D. | NH4-、K+、Cl-、OH- |
分析 A.碳酸根离子与氢离子反应;
B.铁离子与碘离子、硫氰根离子反应;
C.四种离子之间不发生反应,能够共存;
D.铵根离子与氢氧根离子反应.
解答 解:A.H+、CO32-之间发生反应,在原子不能大量共存,故A错误;
B.Fe3+与I-、SCN-反应,在溶液中不能大量共存,故B错误;
C.Al3-、Cu2+、SO42-、NO3-之间不发生反应,在溶液中能够大量共存,故C正确;
D.NH4+、OH-之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
11.25℃时,下列各组离子在指定溶液中可能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 无色溶液中:Cu2+、Al3+、NH4+、Cl- | |
| C. | 由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| D. | 0.1mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
1.表为元素周期表的一部分,请回答下列问题:
(1)元素③在元素周期表中的位置是第二周期VA族.
(2)④和⑤两种元素的最高价氧化物对应水化物酸性较弱的是H2SO4(填化学式),②和④两种元素中,原子半径较大的是Al(填元素符号).
(3)元素①的氢氧化物与元素⑤的单质在常温下反应,化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
(2)④和⑤两种元素的最高价氧化物对应水化物酸性较弱的是H2SO4(填化学式),②和④两种元素中,原子半径较大的是Al(填元素符号).
(3)元素①的氢氧化物与元素⑤的单质在常温下反应,化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O.
8.在一定温度下,反应:2A(s)+2B(g)?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
| A. | A的质量不再改变 | |
| B. | 混合气的密度不再随时间而变化 | |
| C. | 容器内的压强不随时间而变化 | |
| D. | 单位时间内生成2a mol B,同时生成a mol C |
5.利尿酸是奥运会禁止使用的兴奋剂之一,其结构简式如图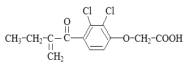 .下列有关利尿酸的说法中正确的是( )
.下列有关利尿酸的说法中正确的是( )
 .下列有关利尿酸的说法中正确的是( )
.下列有关利尿酸的说法中正确的是( )| A. | 分子式是C13H14O4Cl2 | |
| B. | 1mol利尿酸最多能与5mol H2发生加成反应 | |
| C. | 一定条件下能发生加聚、缩聚反应 | |
| D. | 分子内处于同一平面内的原子不超过10个 |




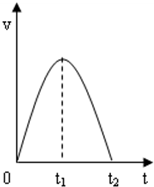 (1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.