题目内容
6.次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)在印染、医药以及原子能工业中应用广泛.某化学兴趣小组以NaHSO3、HCHO、浓硫酸和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: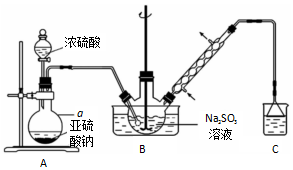
步骤1:利用装置A制备SO2.
步骤2:在三颈烧瓶中(装置如图所示)加入一定量NaHSO3和水,搅拌溶解,打开分液漏斗活塞,
缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液.
步骤3:将装置B中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤.
步骤4:将滤液真空蒸发浓缩,冷却结晶.
(1)仪器a名称是圆底烧瓶.检查A装置气密性良好的方法是用止水夹夹住A、B间的橡胶管,打开分液漏斗的活塞,向烧瓶中加水,水不再流下.
(2)写出A中发生反应的化学方程式Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置C的作用是吸收尾气,防止污染空气.
(4)①步骤3中,反应生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是
快速搅拌.
②冷凝管的作用是冷凝回流,提高原料的利用率.
(5)次硫酸氢钠甲醛具有强还原性,且在120℃以上发生分解.步骤3中不在敞口容器中蒸发浓缩的原因是防止产物被空气氧化.
分析 (1)根据仪器构造可知;根据装置内外的压强差析;
(2)装置A中为亚硫酸钠与浓硫酸反应制备二氧化硫的反应;
(3)二氧化硫污染空气,需要尾气吸收;
(4)①搅拌防止氢氧化锌覆盖在锌粉上阻止反应进行;
②根据仪器作用分析;
(5)由于次硫酸氢钠甲醛具有强还原性,所以蒸发浓缩时不能在敞口容器中进行.
解答 解:(1)仪器a为圆底烧瓶;用止水夹夹住A、B间的橡胶管,打开分液漏斗的活塞,向烧瓶中加水,水不再流下,说明装置气密性良好;
故答案为:圆底烧瓶;用止水夹夹住A、B间的橡胶管,打开分液漏斗的活塞,向烧瓶中加水,水不再流下;
(2)装置A中为亚硫酸钠与浓硫酸反应制备二氧化硫,化学反应为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(3)二氧化硫污染空气,C将二氧化硫吸收,防止其污染空气;
故答案为:吸收尾气,防止污染空气;
(4)①防止Zn(OH)2 覆盖在锌粉表面阻止反应进行,可以通过快速搅拌的方法;
故答案为:快速搅拌;
②冷凝管起冷凝回流的作用,可以提高原料的利用率;
故答案为:冷凝回流,提高原料的利用率;
(5)次硫酸氢钠甲醛具有还原性,在敞口容器中蒸发浓缩,可以被空气中的氧气氧化变质;
故答案为:防止产物被空气氧化.
点评 本题考查了实验制备方案的设计,实验步骤的操作,仪器使用方法,反应过程中的物质判断,题目难度中等.

练习册系列答案
相关题目
16.下列各选项中的离子可大量共存的是( )
| A. | H+、Na+、NO3-、CO32- | B. | Fe3+、K+、I-、SCN | ||
| C. | Al3-、Cu2+、SO42-、NO3- | D. | NH4-、K+、Cl-、OH- |
14.将两种互不相溶的液体分离的方法是( )
| A. | 分液 | B. | 结晶 | C. | 纸层析 | D. | 过滤 |
11.下列实验方案能达到实验目的是( )
| 选项 | 目的 | 实验方案 |
| A. | 比较Mg、Al的金属性 | 将去除氧化膜的镁条、铝片分别放入沸水中 |
| B. | 鉴别MgCl2和 AlCl3溶液 | 将过量稀氨水分别滴入MgCl2和 AlCl3溶液中 |
| C. | 证明苯环对羟基活性的影响 | 分别向苯和苯酚溶液中滴加饱和溴水 |
| D. | 比较浓度对反应速率的影响 | 将不同浓度的KMnO4溶液、稀H2SO4与同浓度的H2C2O4溶液混合 |
| A. | A | B. | B | C. | C | D. | D |
18.下列化学方程式或离子方程式正确的是( )
| A. | 用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 草酸溶液中滴加酸性高锰酸钾溶液5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O | |
| C. | 甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2 $\stackrel{△}{→}$ HCOOH+Cu2O↓+2H2O | |
| D. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH- $\stackrel{△}{→}$ CH2=CH2↑+Br-+H2O. |
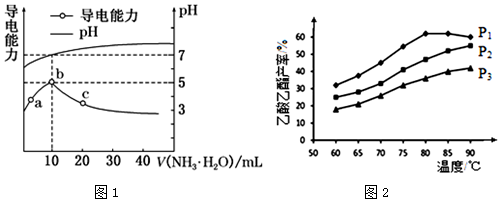
 磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1
磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1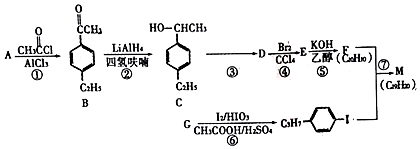
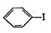 +H≡C-H→
+H≡C-H→ =C+H,回答下列问题:
=C+H,回答下列问题: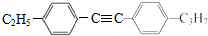 ,A的名称为乙苯.
,A的名称为乙苯. .
.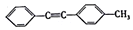 的合成路线:
的合成路线: