题目内容
5.利尿酸是奥运会禁止使用的兴奋剂之一,其结构简式如图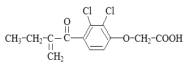 .下列有关利尿酸的说法中正确的是( )
.下列有关利尿酸的说法中正确的是( )| A. | 分子式是C13H14O4Cl2 | |
| B. | 1mol利尿酸最多能与5mol H2发生加成反应 | |
| C. | 一定条件下能发生加聚、缩聚反应 | |
| D. | 分子内处于同一平面内的原子不超过10个 |
分析 A.根据结构简式确定分子式;
B.利尿酸中碳碳双键、羰基、苯环都能和氢气在一定条件下发生加成反应;
C.该分子中含有碳碳双键,具有烯烃性质;含有羧基且只有一个羧基,所以不能发生缩聚反应;
D.乙烯中所有原子共平面、苯中所有原子共平面,单键能自由旋转.
解答 解:A.根据结构简式确定分子式为C13H12O4Cl2,故A错误;
B.利尿酸中碳碳双键、羰基、苯环都能和氢气在一定条件下发生加成反应,所以1mol利尿酸最多能与5mol H2发生加成反应,故B正确;
C.该分子中含有碳碳双键,具有烯烃性质,所以能发生加聚反应;含有羧基且只有一个羧基,所以不能发生缩聚反应,故C错误;
D.乙烯中所有原子共平面、苯中所有原子共平面,单键能自由旋转,所以该分子中最多有20个原子共平面,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系、原子共面判断方法是解本题关键,难点是D选项中原子共面个数判断.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
16.自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:KCl+Na?NaCl+K+Q (Q<0)
有关数据如表:
(1)请结合平衡移动理论分析,为什么能用该反应制备金属钾.化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾).
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃.
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有适当的升高温度或移去钾蒸气.(任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有生产工艺无污染,操作简便.
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=$\frac{c(K)}{c(Na)}$.
有关数据如表:
| 熔点℃ | 沸点℃ | 密度 (g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500 | 1.984 |
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃.
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有适当的升高温度或移去钾蒸气.(任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有生产工艺无污染,操作简便.
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=$\frac{c(K)}{c(Na)}$.
16.下列各选项中的离子可大量共存的是( )
| A. | H+、Na+、NO3-、CO32- | B. | Fe3+、K+、I-、SCN | ||
| C. | Al3-、Cu2+、SO42-、NO3- | D. | NH4-、K+、Cl-、OH- |
13.下列关于氯气的叙述正确的是( )
| A. | 钠在氯气中燃烧产生白色烟雾 | |
| B. | 氯气可以与铁反应,因此氯气不能贮藏在钢瓶中 | |
| C. | 纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰 | |
| D. | 氯气可用于漂白,这是氯气的漂白作用 |
20.下列说法正确的是( )
| A. | 同主族元素从上到下,其氢化物的稳定性逐渐增强 | |
| B. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| C. | 同周期元素(0族除外) 从左到右,原子半径逐渐减小 | |
| D. | 盐酸的酸性强于碳酸,所以非金属性:Cl>C |
10.下列各项中正确的是( )
| A. | 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯 | |
| B. | 淀粉与纤维素不互为同分异构体,但二者完全水解的产物相同 | |
| C. | 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程 | |
| D. | 对苯二甲酸( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚醋纤维( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚醋纤维( ) ) |
14.将两种互不相溶的液体分离的方法是( )
| A. | 分液 | B. | 结晶 | C. | 纸层析 | D. | 过滤 |
 磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1
磺酰氯( SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g)+Cl2(g)?SO2Cl2(g)△H=-97.3kJ•mol-1