题目内容
7. (1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.
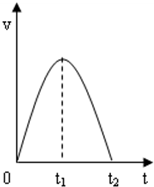
(1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.(2)该反应产生气泡的速率时间图象如图所示,0~t1时刻速率增大的原因是反应放热溶液温度升高,速率增大,t1~t2速率减小的原因是盐酸逐渐消耗,H+浓度减小,速率减小直到反应结束.
(3)改变下列条件对铝与盐酸反应产生气泡的速率的影响分别是(填“增大”、“减小”、“不变”):
①改成等浓度的稀硫酸增大.
②增大盐酸的体积不变.
③稍稍加热盐酸增大.
④加入少量固体NaCl以增大盐酸中Cl-浓度不变.
⑤再加入少量相同的Al粉不变.
⑥通入少量HCl气体增大.
分析 (1)铝比铁活泼,与盐酸反应剧烈,生成氯化铝和氢气;
(2)0~t1时刻,该反应放热导致反应速率加快;t1~t2时氢离子浓度减小,反应速率减小;
(3)用铝与稀盐酸反应制取氢气时,增大氢离子的浓度、升高温度、增大接触面积等可加快反应速率,以此来解答.
解答 解:(1)铝比铁活泼,与盐酸反应剧烈,生成氯化铝和氢气,反应的离子方程式为:2Al+6H+=2Al3++3H2↑,
故答案为:>;2Al+6H+=2Al3++3H2↑;
(2)2Al+6H+=2Al3++3H2↑为放热反应,0~t1时刻反应放热溶液温度升高,速率增大;由于盐酸逐渐消耗,H+浓度减小,t1~t2段反应速率减小直到反应结束,
故答案为:反应放热溶液温度升高,速率增大;盐酸逐渐消耗,H+浓度减小,速率减小直到反应结束;
(3)①改成等浓度的稀硫酸,氢离子浓度增大,反应速率增大,
故答案为:增大;
②增大盐酸的体积,氢离子浓度不变,则反应速率不变,
故答案为:不变;
③稍稍加热盐酸,温度升高,反应速率增大,
故答案为:增大;
④加入少量固体NaCl,对氢离子浓度无影响,则反应速率不变,
故答案为:不变;
⑤再加入少量相同的Al粉,浓度不变,反应速率不变,
故答案为:不变;
⑥通入少量HCl气体,盐酸浓度增大,反应速率增大,
故答案为:增大.
点评 本题考查影响化学反应速率的因素,为高频考点,明确温度、浓度、催化剂对反应的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
18.短周期元素A、B、C、D的原子序数依次增大,A的L层电子数是K层的3倍,D所在 族序数是周期数的2倍,B、C、D的最外层电子数之和为10.下列说法正确的是( )
| A. | B可以从溶液中置换出C单质 | |
| B. | 简单离子半径:D>A>B>C | |
| C. | A和D形成的化合物溶于水可导电,所以该化合物为电解质 | |
| D. | 最高价氧化物对应的水化物的酸性:A>D |
19.X、Y、Z、W、Q是短周期主族元素,其中X原子最外层电子数是内层电子数的3倍;X与Z同主族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期;X、Y、Z三种元素的族序数之和为16.下列说法正确的是( )
| A. | Z与Q形成化合物的电子式为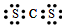 | |
| B. | X与Z、Q形成的化合物均为大气污染物 | |
| C. | Q与W能形成10电子、14电子、18电子分子 | |
| D. | Y、Z、Q分别与X只能组成化学式为AB2型化合物 |
16.自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:KCl+Na?NaCl+K+Q (Q<0)
有关数据如表:
(1)请结合平衡移动理论分析,为什么能用该反应制备金属钾.化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾).
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃.
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有适当的升高温度或移去钾蒸气.(任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有生产工艺无污染,操作简便.
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=$\frac{c(K)}{c(Na)}$.
有关数据如表:
| 熔点℃ | 沸点℃ | 密度 (g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500 | 1.984 |
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为774℃,而反应的最高温度应低于882.9℃.
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有适当的升高温度或移去钾蒸气.(任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有生产工艺无污染,操作简便.
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=$\frac{c(K)}{c(Na)}$.
2.已知反应:
①2H2O(g)=2H2(g)+O2(g)△H1
②Cl2(g)+H2(g)=2HCl△H2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H1、△H2、△H3间的关系正确的是( )
①2H2O(g)=2H2(g)+O2(g)△H1
②Cl2(g)+H2(g)=2HCl△H2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H1、△H2、△H3间的关系正确的是( )
| A. | △H1+△H2=△H3 | B. | △H1-△H2=△H3 | C. | △H1+2△H2=△H3 | D. | △H1-2△H2=△H3 |
12.下列有关原子结构和元素周期律表述正确的是( )
①ⅦA族元素是同周期中非金属性最强的元素
②原子序数为15的元素的最高化合价为+3
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族.
①ⅦA族元素是同周期中非金属性最强的元素
②原子序数为15的元素的最高化合价为+3
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族.
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ③④ |
16.下列各选项中的离子可大量共存的是( )
| A. | H+、Na+、NO3-、CO32- | B. | Fe3+、K+、I-、SCN | ||
| C. | Al3-、Cu2+、SO42-、NO3- | D. | NH4-、K+、Cl-、OH- |