题目内容
18.化学反应SO2+NO2=SO3+NO的反应类型是( )| A. | 化合反应 | B. | 氧化还原反应 | C. | 置换反应 | D. | 复分解反应 |
分析 SO2+NO2=SO3+NO中,N、S元素的化合价变化,为氧化还原反应,不属于四种基本反应类型,以此来解答.
解答 解:A.生成物有两种,不是化合反应,故A不选;
B.N、S元素的化合价变化,为氧化还原反应,故B选;
C.反应物、生成物均无单质,不属于置换反应,故C不选;
D.复分解反应中无元素的化合价变化,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、物质类别为解答的关键,侧重分析与应用能力的考查,注意反应的分类法,题目难度不大.

练习册系列答案
相关题目
20.我国科学家前不久成功合成3nm长的管状碳纳米管,长度居世界之首.这种碳纤维具有强度高、刚度(抵抗变形的能力)高、密度小(只有钢的$\frac{1}{4}$)、熔点高,化学稳定性好的特点,固此被称为“超级纤维”.下列对碳纤维的说法中不正确的是( )
| A. | 它是制造飞机的理想材料 | B. | 它的主要组成元素是碳元素 | ||
| C. | 它的结构与石墨相似 | D. | 碳纤维复合材料不易导电 |
9.某学习小组,用稀HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.00mL、大理石用量为10.00g.
实验设计如表:
将相应的实验目的填入下列空格中:
(1)实验①和②探究浓度对该反应速率的影响;
(2)实验①和③探究温度对该反应速率的影响;
(3)实验①和④探究固体颗粒大小对该反应速率的影响.
实验设计如表:
| 编号 | T/K | 大理石规格 | HNO3浓度 |
| ① | 298 | 粗颗粒 | 2.00 mol•L-1 |
| ② | 298 | 粗颗粒 | 1.00 mol•L-1 |
| ③ | 308 | 粗颗粒 | 2.00 mol•L-1 |
| ④ | 298 | 细颗粒 | 2.00 mol•L-1 |
(1)实验①和②探究浓度对该反应速率的影响;
(2)实验①和③探究温度对该反应速率的影响;
(3)实验①和④探究固体颗粒大小对该反应速率的影响.
6.下列实验操作或原理正确的是( )
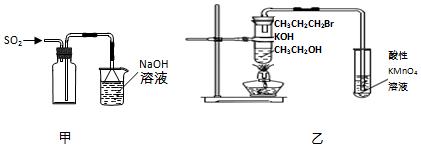

| A. | 用装置甲收集SO2气体 | |
| B. | 用装置乙验证1-溴丙烷发生消去反应是否生成烯烃 | |
| C. | 酸碱中和滴定过程中,眼睛必须注视滴定管刻度的变化 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使所配溶液的浓度偏高 |
13.铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景.
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
| A. | 2FeCO3(s)+$\frac{1}{2}$O2 (g)=Fe2O3(s)+2CO2(g)△H=+130 KJ/mol | |
| B. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol |
10.用沉淀法测定KHCO3和Na2CO3固体混合物的组成,每次称取一定质量的样品溶于水制成洛液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见表:
回答下列问题:
(1)样品中KHCO3和Na2CO3的物质的量之比2:1.
(2)室温下第Ⅲ组实验所得溶液中的OH-物质的量浓度为0.2mol/L.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 样本质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.19 | 11.82 | 17.73 | 23.64 | 23.64 |
(1)样品中KHCO3和Na2CO3的物质的量之比2:1.
(2)室温下第Ⅲ组实验所得溶液中的OH-物质的量浓度为0.2mol/L.
7.下列离子反应方程式,书写正确的是( )
| A. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2+SO42-;氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 硝酸银与氯化氢溶液反应:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 碳酸氢钠溶液与稀硫酸溶液混合:HCO3-+H+=H2O+CO2↑ |
8.标准状况下,下列关于气体的说法中正确的是( )
| A. | 2mol氧气与1mol二氧化硫的质量比约为2:1 | |
| B. | 2mol氧气与1mol二氧化硫的体积比约为1:1 | |
| C. | 1mol氧气与3mol二氧化硫的体积比约为1:3 | |
| D. | 1mol氧气与3mol二氧化硫的密度比约为1:3 |