题目内容
10.用沉淀法测定KHCO3和Na2CO3固体混合物的组成,每次称取一定质量的样品溶于水制成洛液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 样本质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.19 | 11.82 | 17.73 | 23.64 | 23.64 |
(1)样品中KHCO3和Na2CO3的物质的量之比2:1.
(2)室温下第Ⅲ组实验所得溶液中的OH-物质的量浓度为0.2mol/L.
分析 (1)第Ⅲ次实验中样品完全反应,令碳酸氢钠与碳酸钾的物质的量分别为xmol、ymol,根据碳元素守恒可知沉淀碳酸钡的物质的量为(x+y)mol,根据样品质量与碳酸钡沉淀质量列方程计算;
(2)第Ⅲ组实验反应后溶液为氢氧化钡、氢氧化钠、氢氧化钾的混合溶液,由钡离子守恒计算溶液中钡离子物质的量,由钠离子守恒可知,溶液中n(KOH)=n(KHCO3),由钾离子守恒可知,溶液中n(NaOH)=2n(Na2CO3),根据溶液中氢氧化钡、氢氧化钠、氢氧化钾的物质的量计算氢氧根的浓度.
解答 解:(1)第Ⅲ次实验中样品完全反应,令KHCO3与Na2CO3的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{100x+106y=9.18}\\{197x+197y=17.73}\end{array}\right.$,解得x=0.06,y=0.03
故n(KHCO3):n(Na2CO3)=0.06mol:0.03mol=2:1,
故答案为:2:1,
(2)由(1)中分析可知,第Ⅳ次恰好样品完全反应,碳酸钡物质的量=$\frac{23.64g}{197g/mol}$=0.12mol,根据钡离子守恒,300mL氢氧化钡溶液中氢氧化钡的物质的量=0.12mol,第Ⅲ组实验反应后溶液为氢氧化钡、氢氧化钠、氢氧化钾的混合溶液,17.73g碳酸钡物质的量为$\frac{17.73g}{197g/mol}$=0.09mol,由钡离子守恒可知,溶液中n[Ba(OH)2]=0.12mol-0.09mol=0.03mol,由钾离子守恒可知,溶液中n(KOH)=n(KHCO3)=0.06mol,根据钠离子守恒可知,溶液中n(NaOH)=2n(Na2CO3)=0.06mol,
溶液中n(OH-)=2n[Ba(OH)2]+n(NaOH)+n(KOH)=0.03mol×2+0.06mol+0.06mol=0.18mol,第3组实验所得溶液中的OH-浓度为$\frac{0.06mol}{0.3L}$=0.2mol/L,
故答案为:0.2mol/L.
点评 本题考查混合物的计算、实验数据分析处理等,综合性较大,难度较大,旨在考查学生的综合能力,是一道不错的能力考查题.

| A. |  制取金属锰 | |
| B. |  制取二氧化碳 | |
| C. |  蒸发饱和食盐水制取食盐晶体 | |
| D. |  验证FeCl3对H2O2分解反应有催化作用 |
| A. | 化合反应 | B. | 氧化还原反应 | C. | 置换反应 | D. | 复分解反应 |
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液溶液变红 | Fe(NO3)2样品已氧化变质 |
| C | 向盛有少量NaHCO3的试管中滴加草酸溶液有气泡产生 | 酸性:草酸>碳酸 |
| D | 向少量某物质的稀溶液中滴加稀盐酸,产生了能使澄清石灰水变浑浊的气体 | 该物质一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
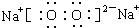 .
.