题目内容
4.下列环境问题主要与SO2有关的是( )| A. | 温室效应 | B. | 臭氧空洞 | C. | 酸雨 | D. | 光化学烟雾 |
分析 二氧化硫与水反应生成亚硫酸,最终被氧化生成硫酸,可导致酸雨,以此解答.
解答 解:A.温室效应主要与二氧化碳的大量排放有关,故A不选;
B.臭氧空洞主要与氟利昂的大量排放有关,故B不选;
C.二氧化硫与水反应生成亚硫酸,最终被氧化生成硫酸,可导致酸雨,故C选;
D.光化学烟雾主要与氮的氧化物的排放有关,故D不选;
故选:C.
点评 本题考查酸雨的形成与防治,为高频考点,侧重于化学环境的考查,熟悉二氧化硫的性质是解题关键,注意对生活中常见环境污染知识的积累.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
3.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用,下表列出了①~⑨九种元素在周期表中的位置.
回答下列问题:
(1)编号元素中,化学性质最不活泼的元素的原子结构示意图是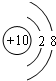 .
.
(2)九种元素中非金属最强的是F(填元素符号),元素⑧的氢化物的结构式为H-Cl.
(3)除⑨外,原子半径最大的是Na(元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是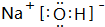 (填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(4)⑥、⑦、⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S(填化学式).
(5)元素④对应的氢化物的电子式为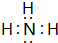 ,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).
,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).
(6)⑦、⑧两种元素最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4(填化学式).
(7)①、⑥离子的电子层结构与⑨原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(填离子符号).
(8)九种元素中的最高价氧化物对应的水化物呈两性的氢氧化物与烧碱溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
(1)编号元素中,化学性质最不活泼的元素的原子结构示意图是
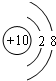 .
.(2)九种元素中非金属最强的是F(填元素符号),元素⑧的氢化物的结构式为H-Cl.
(3)除⑨外,原子半径最大的是Na(元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是
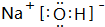 (填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).(4)⑥、⑦、⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S(填化学式).
(5)元素④对应的氢化物的电子式为
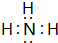 ,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).
,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).(6)⑦、⑧两种元素最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4(填化学式).
(7)①、⑥离子的电子层结构与⑨原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(填离子符号).
(8)九种元素中的最高价氧化物对应的水化物呈两性的氢氧化物与烧碱溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
4.下列化学用语书写正确的是( )
| A. | 醋酸与NaOH溶液反应的离子方程式为:H++OH-═H2O | |
| B. | 金属钠与乙醇反应的化学方程式为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ | |
| C. | 聚氯乙烯的结构简式为: | |
| D. | 工业上制取Cl2的离子方程式为:2Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
12. 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处建一座硫酸厂,你认为厂址宜选在C的郊区(填标号).
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为4CuFeS2+13O2=4CuO+2Fe2O3+8SO2;
(3)为了有利于SO2转化SO3,多采用如图所示的装有多层催化剂的接触室(填设备名称)作为反应设备,让气体经历如图所示流程而不是直接进入该设备进行反应的原因是使热量能充分利用.
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是D
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中 燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中的二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据如表信息,结合工业生产实际,选择最合适的生产条件是400℃、1个大气压.
(6)由吸收塔排出的尾气中SO2的含量超过500umol/L,就要用氨水洗涤烟气脱硫,该反应的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
(7)若用浓硫酸吸收SO3可以得到H2SO4•SO3.用1000g 98% 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是C
A.1.98kg B.2.00kg C.2.22kg D.2.42kg.
 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.(1)若从下列四个城市中选择一处建一座硫酸厂,你认为厂址宜选在C的郊区(填标号).
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为4CuFeS2+13O2=4CuO+2Fe2O3+8SO2;
(3)为了有利于SO2转化SO3,多采用如图所示的装有多层催化剂的接触室(填设备名称)作为反应设备,让气体经历如图所示流程而不是直接进入该设备进行反应的原因是使热量能充分利用.
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是D
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中 燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中的二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据如表信息,结合工业生产实际,选择最合适的生产条件是400℃、1个大气压.
| 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 | |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(7)若用浓硫酸吸收SO3可以得到H2SO4•SO3.用1000g 98% 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是C
A.1.98kg B.2.00kg C.2.22kg D.2.42kg.
19.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
| A. | NH4+、CO32-、K+、Na+ | B. | Na+、Ba2+、Cl-、HCO3- | ||
| C. | NO3-、Cu2+、K+、SO42- | D. | K+,Na+,Cl-,NO3- |
9.能大量共存于同一溶液中的离子组是( )
| A. | Ba2+、K+、SO42- | B. | Ca2+、NO3-、Cl- | C. | Na+、Mg2+、OH- | D. | H+、Cl-、HCO3- |
16.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色,见光分解变成褐色;如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
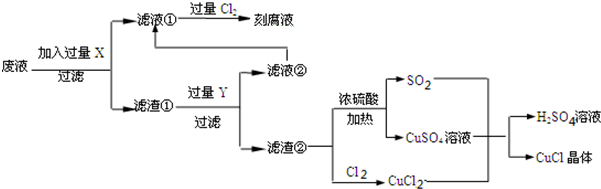
根据以上信息回答下列问题:
(1)该生产过程可以与氯碱工业、硫酸工业生产相结合,现代氯碱工业的装置名称是离子交换膜电解槽_此空删去.
(2)流程中的X是Fe,Y是HCl (均填化学式).
(3)产生CuCl的化学方程式为CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)为了提髙CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水洗涤而用无水乙醇洗涤,其目的是CuCl微溶于水、不溶于乙醇,用乙醇洗涤可减少产品CuCl的损失,生产过程中控制溶液的pH不能过大的原因是溶液pH大会促进CuCl的水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL、邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.同时做空白试验一次.已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+,如此再重复二次实验得到以下数据:
(说明:空白试验指在不加试样的情况下按试样分析规程在同样的操作条件下进行的分析,所得结果的数值为空白值)
④数据处理:计算得该工业CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)

根据以上信息回答下列问题:
(1)该生产过程可以与氯碱工业、硫酸工业生产相结合,现代氯碱工业的装置名称是离子交换膜电解槽_此空删去.
(2)流程中的X是Fe,Y是HCl (均填化学式).
(3)产生CuCl的化学方程式为CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)为了提髙CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水洗涤而用无水乙醇洗涤,其目的是CuCl微溶于水、不溶于乙醇,用乙醇洗涤可减少产品CuCl的损失,生产过程中控制溶液的pH不能过大的原因是溶液pH大会促进CuCl的水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL、邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.同时做空白试验一次.已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+,如此再重复二次实验得到以下数据:
| 1 | 2 | 3 | |
| 空白试验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得该工业CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)
14.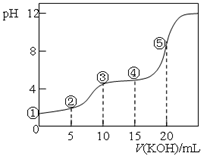 常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
 常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| C. | 点③所示溶液中:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05mol•L-1 | |
| D. | 点⑤所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |