题目内容
3.按要求填空:(1)用系统命名法命名下列物质
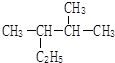 2,3-二甲基戊烷
2,3-二甲基戊烷(2)写出下列有机物的结构简式:2-甲基-1-戊烯CH2=C(CH3)CH2CH2CH3
(3)写出下列有机物的键线式:
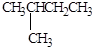

(4)写出下列物质的分子式:
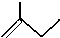 C5H10
C5H10(5)
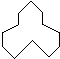 名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.
名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.(6)分子中含有22个共价键的烷烃C7H16.
分析 (1)烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子进行编号;
(2)根据名称可知,在1号和2号碳原子之间有碳碳双键,在号碳原子上有一个甲基,据此写出结构简式;
(3)根据结构式再写出键线式的方法:碳碳键用线段来表现,画出键线式.拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略;
(4)有机物的键线式中每个拐点有个碳原子,键的边缘有一个碳原子,根据每个碳原子形成4个共价键确定氢原子个数,从而写出其分子式;
(5)改物质有12个碳,为环烷烃,根据烃的燃烧规律和耗氧量来回答;
(6)令烷烃的组成为CnH2n+2,含有的共价键数目为3n+1,据此可知有22个共价键的烷烃中碳原子数目为7.
解答 解:(1)烷烃命名时,要选最长的碳链为主链,故主链上有5个碳原子,从离支链近的一端给主链上碳原子进行编号,则在2号和3号碳原子上各有一个甲基,故名称为:2,3-二甲基戊烷,故答案为:2,3-二甲基戊烷;
(2)依据系统命名方法,结合名称写出结构简式,2-甲基-1-戊烯的结构简式是:CH2=C(CH3)CH2CH2CH3,故答案为:CH2=C(CH3)CH2CH2CH3;
(3)书写键线式时,碳碳键用线段来表现,画出键线式.拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略;故
 ,故答案为:
,故答案为: ;
;
(4)有机物的键线式中每个拐点有个碳原子,键的边缘有一个碳原子,根据每个碳原子形成4个共价键确定氢原子个数,从而 分子式为:C5H10,故答案为:C5H10;
分子式为:C5H10,故答案为:C5H10;
(5)根据键线式,可以知道有机物中有12个碳原子,所以名称是环十二烷,有机物质燃烧的耗氧量=碳原子数+$\frac{氢原子数目}{4}$,即为12+$\frac{24}{4}$=18,故答案为:环十二烷;18;
(6)令烷烃的组成为CnH2n+2,含有的共价键数目为3n+1,该烷烃有22个共价键,则:3n+1=22,解得,n=7,所以该烷烃中碳原子数目为7,分子式为C7H16,
故答案为:C7H16.
点评 本题考查了键线式的书写及根据键线式确定分子式、物质的结构简式和烃的燃烧规律、根据共价键计算烷烃中碳原子数目,必须明确每个碳原子形成4个共价键,难度不大.

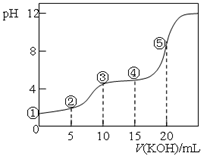 常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| C. | 点③所示溶液中:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05mol•L-1 | |
| D. | 点⑤所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
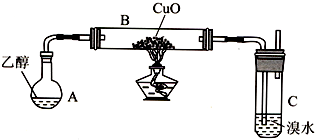
(1)实验开始时,对A进行水浴加热,其目的是产生平稳的乙醇气流.
(2)B中反应方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
(3)若装置C中开始发生倒吸,则采取的应急措施是C(填编号).
A.移去图中的酒精灯B.将C中橡皮塞上的短导气管拔出
C.将B尾端的乳胶管取下D.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色.学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br-)来确定乙醛使溴水褪色的原因.
①假设.请写出假设1的反应类型.
假设1:CH3CHO+Br2→CH2BrCHO+HBr;取代反应
假设2:CH3CHO+Br2→CH3CHBrOBr; 加成反应
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr. 氧化反应
②结论:若实验测得n(Br2)=0.005mol,n(Br-)=0.01mol,则证明假设3正确.
(5)欲检验乙醇中混有的少量乙醛,甲乙丙三同学设计实验如表:
| 试剂、用品 | 预期现象 | |
| 甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
| 乙 | 溴水 | 溴水褪色 |
| 丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |
| A. | HCl | B. | CH3COONa | C. | FeCl3 | D. | NaCl |

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为Cu2++2eˉ=Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b用导线连接时,电流从铁片经导线流向铜片 |

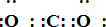 ;写出物质E的电子式:
;写出物质E的电子式: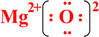 .
.