题目内容
12.三草酸合铁酸钾晶体是一种光敏材料,可以通过下列流程来制备: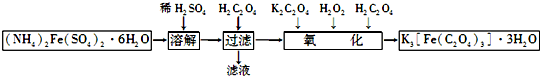
(1)“过滤”前加入H2C2O4的目的是将Fe2+转化为FeC2O4•2H2O沉淀;“氧化”时加入H2C2O4的目的是:①参与“氧化”时的反应,②调节溶液的pH.
(2)“氧化”过程中反应的化学方程式为2FeC2O4•2H2O+H2O2+3K2C2O4+H2C2O4═2K3[Fe(C2O4)3]•3H2O.
(3)称取9.82g K3[Fe(C2O4)3]•3H2O固体加热分解,在110℃时完全失去结晶水;继续加热到一定温度,反应一段时间后得到混合气体CO、CO2(标准状况下的体积为2.016L)和固体M.研究分析可知:M中含有K2CO3和另外两种物质(铁元素不以三价形式存在);M的质量为5.42g.
①CO的物质的量为0.04mol.
②计算M中各成分的物质的量(写出计算过程).
分析 废铁屑加入硫酸溶液溶解,稀硫酸防止亚铁离子水解,加入草酸沉淀亚铁离子,过滤得到沉淀加入重铬酸钾、过氧化氢溶液氧化加入草酸得到草酸合铁酸钾晶体.
(1)加入H2C2O4调节溶液的pH的同时还可以做氧化剂;
(2)双氧水可以将草酸亚铁氧化,据此回答;
(3)根据C、Fe元素守恒和质量守恒关系列式计算.
解答 解:废铁屑加入硫酸溶液溶解,稀硫酸防止亚铁离子水解,加入草酸沉淀亚铁离子,过滤得到沉淀加入重铬酸钾、过氧化氢溶液氧化加入草酸得到草酸合铁酸钾晶体.
(1)“过滤”前加入H2C2O4的目的是将Fe2+转化为FeC2O4•2H2O沉淀;“氧化”时加入H2C2O4的目的:既可以参与“氧化”时的反应,又可以调节溶液的pH(或避免生成氢氧化铁),故答案为:调节溶液的pH;
(2)双氧水可以将草酸亚铁氧化,发生反应:2FeC2O4•2H2O+H2O2+3K2C2O4+H2C2O4═2K3[Fe(C2O4)3]•3H2O,故答案为:2FeC2O4•2H2O+H2O2+3K2C2O4+H2C2O4═2K3[Fe(C2O4)3]•3H2O;
(3)①9.82g K3[Fe(C2O4)3]•3H2O固体加热分解,得到混合气体CO、CO2(标准状况下的体积为2.016L)和固体M,n{K3[Fe(C2O4)3]•3H2O}=9.82 g/491 g•mol-1=0.02mol,失去结晶水的质量是:0.06mol×18g/mol=1.08g,M的质量为5.42g,所以一氧化碳和二氧化碳的总质量是9.82g-1.08g-5.42g=3.32g,标准状况下的体积为2.016L,即0.09mol,设一氧化碳的物质的量是x,则28x+(0.09-x)×44=3.32,解得x=0.04mol,故答案为:0.04mol;
②n{K3[Fe(C2O4)3]•3H2O}=$\frac{9.82g}{491g/mol}$=0.02 mol,n(C)=0.12mol,标准状况下的体积为2.016L,即0.09mol,根据C元素守恒,碳酸钾的物质的量是0.12mol-0.09mol=0.03mol,而5.42g M中n(K2CO3)=0.02 mol×3÷2=0.03 mol,由此可知另两种物质中不含碳元素,另两种物质的质量为5.42g-138g•mol×0.03 mol=1.28g,据铁元素守恒:=0.02 molK3[Fe(C2O4)3]中m(Fe)=56g/mol×0.02 mol=1.12 g,m(O)=1.28g-1.12g=0.16g,M中不含三价铁元素,铁元素的物质的量为n(Fe)=0.02mol氧元素的物质的量为n(O)=0.01 mol,则另两种物质为Fe和FeO,n(Fe)=0.01 mol,n(FeO)=0.01mol,答:M中各成分的物质的量如下:n(Fe)=0.01 mol,n(FeO)=0.01mol,n(K2CO3)=0.03mol.
点评 本题以氧化还原反应为载体,考查学生物质的组成和提纯知识的综合应用,属于综合知识的考查,难度不大.

| A. | 光伏发电是将化学能转化为电能 | |
| B. | 钢铁吸氧腐蚀正极的电极反应式是O2+4e-+2H2O=4OH- | |
| C. | 通过电解NaCl水溶液的方法生产金属钠 | |
| D. | 铅蓄电池的负极材料是Pb,正极材料是PbSO4 |
| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
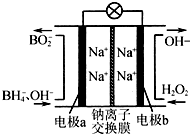 硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )
硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )| A. | 电极a为正极,b为负极 | |
| B. | 放电时,Na+从b极区移向a极区 | |
| C. | 电极b上发生的电极反应为H2O2+2e-═2OH- | |
| D. | 每生成1 mol BO2-转移6 mol电子 |
| A. | 使甲基橙变红色的溶液中:Ca2+、Mg2+、HCO3-、Cl- | |
| B. | 使KSCN变红色的溶液中:NH4+、S2-、Br-、I- | |
| C. | c(H+)/c(OH-)=1012 的溶液中:Cu2+、Al3+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)•c(OH-)=10-8的溶液中:Na+、K+、AlO2-、CO32- |
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
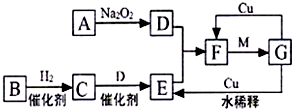 下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体.
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体. .
.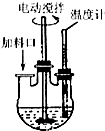 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.