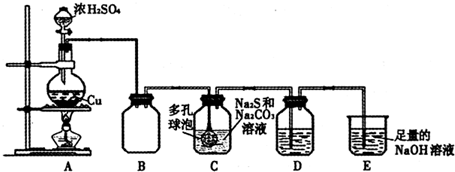
题目内容
20.某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素.该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
(2)实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是Ⅱ 和Ⅲ,实验结论是其他因素不变,固体表面积越大,反应速率越快;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
分析 (1)由实验数据可知,Ⅱ、Ⅲ中接触面积不同,I、Ⅱ中温度不同;
(2)Ⅰ和Ⅱ表明,温度高的反应时间少;
(3)Ⅱ、Ⅲ中接触面积不同,接触面积大的反应时间少;
(4)证明盐酸的浓度对该反应的速率的影响,利用相同的Zn与不同浓度的盐酸反应.
解答 解:(1)由实验数据可知,Ⅱ、Ⅲ中接触面积不同,I、Ⅱ中温度不同,则该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响,
故答案为:固体表面积;温度;
(2)Ⅰ和Ⅱ表明,温度高的反应时间少,则表明温度越高,反应速率越大,故答案为:温度越高;
(3)Ⅱ、Ⅲ中接触面积不同,接触面积大的反应时间少,则能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ,实验结论是其他因素不变,固体表面积越大,反应速率越快,
故答案为:Ⅱ;Ⅲ;其他因素不变,固体表面积越大,反应速率越快;
(4)证明盐酸的浓度对该反应的速率的影响,利用相同的Zn与不同浓度的盐酸反应,则设计实验为在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应,
故答案为:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
点评 本题考查化学反应速率的影响因素,为高考常见题型和高频考点,把握常见外界因素对反应速率的影响为解答的关键,侧重分析与实验能力的考查,注意相关基础知识的积累,题目难度不大.

练习册系列答案
相关题目
16.在元素周期表这哪个区域寻找新的催化剂和制造耐高温、耐腐蚀的合金材料( )
| A. | 碱金属 | B. | 周期表右上角非金属元素 | ||
| C. | 金属与非金属分界线附近的元素 | D. | 过渡元素 |
15.下列各电子式中正确的是( )
| A. | 氯原子 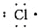 | B. | 氟原子 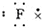 | C. | 溴化钡 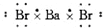 | D. | 硫化钾 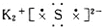 |
5.不能说明元素X的电负性比元素Y的大的是( )
| A. | X原子的最外层电子数比Y原子最外层电子数多 | |
| B. | X的最高价氧化物水化物的酸性比Y的最高价氧化物水化物的酸性强 | |
| C. | 与H2化合时X形成的单质比Y形成的单质容易 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在pH=12的溶液中:K+、Na+、ClO-、NO3- |
10.实验室可用铁片与稀硫酸反应制氢气.下列措施中,不能使氢气生成速率加大的是( )
| A. | 加热 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 将铁片改为镁条 | D. | 不用铁片,改用铁粉 |
 .
.