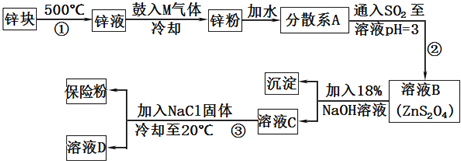
题目内容
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在pH=12的溶液中:K+、Na+、ClO-、NO3- |
分析 A.pH=1的溶液,显酸性;
B.离子之间相互促进水解;
C.离子之间发生氧化还原反应,离子之间结合生成络离子;
D.pH=12的溶液,显碱性.
解答 解:A.pH=1的溶液,显酸性,不能大量存在HCO3-,故A错误;
B.Al3+、CO32-相互促进水解,不能大量共存,故B错误;
C.Fe3+、I-发生氧化还原反应,Fe3+、SCN-结合生成络离子,不能大量共存,故C错误;
D.pH=12的溶液,显碱性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、水解反应的发生,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.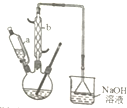 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:

实验步骤如下:
Ⅰ.在三颈烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗a中盛放有5.4mL环己醇.
Ⅱ.水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三颈烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)装置中仪器b的名称为球形冷凝管,使用时要从下口(填“上口”或“下口”)通入冷水.滴液漏斗的细支管a的作用是平衡滴液漏斗与圆底烧瓶内压强,便于环己醇顺利流下.
(2)本实验所用50%的硝酸物质的量浓度为10.4mol/L;实验中,氮氧化物废气(主要成分为NO2和NO)可以用NaOH溶液来吸收,其主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O
其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2;NO+NO2+Na2CO3=2NaNO2+CO2.
(3)向三颈烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三颈烧瓶置于冰水浴中.
(4)为了除去可能的杂质和减少产品损失,可依次用冰水和苯洗涤晶体.
 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
Ⅰ.在三颈烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗a中盛放有5.4mL环己醇.
Ⅱ.水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三颈烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)装置中仪器b的名称为球形冷凝管,使用时要从下口(填“上口”或“下口”)通入冷水.滴液漏斗的细支管a的作用是平衡滴液漏斗与圆底烧瓶内压强,便于环己醇顺利流下.
(2)本实验所用50%的硝酸物质的量浓度为10.4mol/L;实验中,氮氧化物废气(主要成分为NO2和NO)可以用NaOH溶液来吸收,其主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O
其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2;NO+NO2+Na2CO3=2NaNO2+CO2.
(3)向三颈烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三颈烧瓶置于冰水浴中.
(4)为了除去可能的杂质和减少产品损失,可依次用冰水和苯洗涤晶体.
20.某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素.该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
(1)该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是Ⅱ 和Ⅲ,实验结论是其他因素不变,固体表面积越大,反应速率越快;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
(2)实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是Ⅱ 和Ⅲ,实验结论是其他因素不变,固体表面积越大,反应速率越快;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
17.下列叙述中正确的是( )
| A. | O22-与S2-具有相同的质子数和电子数 | |
| B. | H、D、T互为同位素,H2O、D2O、T2O互为同素异形体 | |
| C. | 碱金属元素是指 IA族的所有元素 | |
| D. | 周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
4.下列设计的实验方案能达到实验目的是( )
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 浸有KMnO4(H+)溶液的滤纸中滴加SO2水溶液,滤纸褪色,说明SO2具有漂白性 |