题目内容
15.下列各电子式中正确的是( )| A. | 氯原子  | B. | 氟原子  | C. | 溴化钡  | D. | 硫化钾  |
分析 A.氯原子最外层7个电子;
B.氟原子最外层7个电子;
C.溴化钡为离子化合物,钡离子与两个溴离子通过离子键结合;
D.硫化钾为离子化合物,2个钾离子与硫离子通过离子键结合,注意钾离子不能合写.
解答 解:A.氯原子最外层7个电子,电子式为: ,故A正确;
,故A正确;
B.氟原子最外层7个电子,电子式: ,故B错误;
,故B错误;
C.溴化钡为离子化合物,电子式为: ,故C错误;
,故C错误;
D.硫化钾为离子化合物,钾离子不能合并,电子式为: ,故D错误;
,故D错误;
故选:A.
点评 本题考查电子式的书写,注意电子式书写注意事项:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
11.下列实验装置图(部分夹持装置略去)正确的是( )
| A. |  实验室制备及收集乙烯 | B. |  石油分馏 | ||
| C. |  实验室制硝基苯 | D. |  用于分离乙醇和水 |
6.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
| A. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| B. | 滴定结束后,滴定管尖嘴处有一悬挂液滴 | |
| C. | 取NaOH溶液时先平视读数,后仰视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2次~3次 |
3.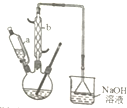 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:

实验步骤如下:
Ⅰ.在三颈烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗a中盛放有5.4mL环己醇.
Ⅱ.水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三颈烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)装置中仪器b的名称为球形冷凝管,使用时要从下口(填“上口”或“下口”)通入冷水.滴液漏斗的细支管a的作用是平衡滴液漏斗与圆底烧瓶内压强,便于环己醇顺利流下.
(2)本实验所用50%的硝酸物质的量浓度为10.4mol/L;实验中,氮氧化物废气(主要成分为NO2和NO)可以用NaOH溶液来吸收,其主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O
其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2;NO+NO2+Na2CO3=2NaNO2+CO2.
(3)向三颈烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三颈烧瓶置于冰水浴中.
(4)为了除去可能的杂质和减少产品损失,可依次用冰水和苯洗涤晶体.
 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
Ⅰ.在三颈烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗a中盛放有5.4mL环己醇.
Ⅱ.水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三颈烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)装置中仪器b的名称为球形冷凝管,使用时要从下口(填“上口”或“下口”)通入冷水.滴液漏斗的细支管a的作用是平衡滴液漏斗与圆底烧瓶内压强,便于环己醇顺利流下.
(2)本实验所用50%的硝酸物质的量浓度为10.4mol/L;实验中,氮氧化物废气(主要成分为NO2和NO)可以用NaOH溶液来吸收,其主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O
其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2;NO+NO2+Na2CO3=2NaNO2+CO2.
(3)向三颈烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三颈烧瓶置于冰水浴中.
(4)为了除去可能的杂质和减少产品损失,可依次用冰水和苯洗涤晶体.
10.下列四个反应中,与其它三个反应类型不同的是( )
| A. | CH3CHO+H2$\stackrel{Ni}{→}$CH3CH2OH | |
| B. | CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O | |
| C. | CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| D. | 2CH3CHO+O2$\stackrel{△}{→}$2CH3COOH |
20.某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素.该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
(1)该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是Ⅱ 和Ⅲ,实验结论是其他因素不变,固体表面积越大,反应速率越快;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
(2)实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是Ⅱ 和Ⅲ,实验结论是其他因素不变,固体表面积越大,反应速率越快;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
4.下列设计的实验方案能达到实验目的是( )
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 浸有KMnO4(H+)溶液的滤纸中滴加SO2水溶液,滤纸褪色,说明SO2具有漂白性 |
5.下列关于周期表中第三周期元素性质从左到右变化趋势的叙述,错误的是( )
| A. | 最高正价依次升高 | |
| B. | 气态氢化物稳定性逐渐增强 | |
| C. | 原子半径逐渐增大 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强 |