题目内容
16.在元素周期表这哪个区域寻找新的催化剂和制造耐高温、耐腐蚀的合金材料( )| A. | 碱金属 | B. | 周期表右上角非金属元素 | ||
| C. | 金属与非金属分界线附近的元素 | D. | 过渡元素 |
分析 元素周期表中位置相近的元素性质相似,因此人们可以在元素周期表中一定的区域内研究合成有特定性质的新物质.如在金属和非金属的分界线附近寻找半导体材料(如锗、硅、硒等),在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素).
解答 解:优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素)大多属于过渡元素,故选D.
点评 本题考查元素的性质、位置以及用途,题目难度不大,属于周期表的应用问题,注意把握周期表中元素的排列规律.

练习册系列答案
相关题目
6.用酸性氢氧燃料电池电解饱和食盐水的装置如图所示 (a、b为石墨电极).下列说法中,正确的是( )
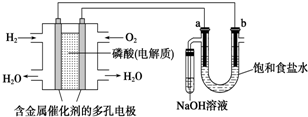

| A. | 电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- | |
| B. | 忽略能量损耗,当电池中消耗0.1g H2时,b极周围会产生1.12L H2 | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 电解时,a 电极周围首先放电的是Cl- |
7.某有机物的核磁共振氢谱图如下,该有机物可能是( )


| A. | CH3-CH2-CH3 | B. | CH3CH2 CH2Br | C. |  | D. |  |
4.从海水中提取溴,主要反应为:2Br -+Cl2=Br2+2Cl-,下列说法正确的是( )
| A. | 溴离子具有氧化性 | B. | 溴单质是氧化剂 | ||
| C. | 该反应属于复分解反应 | D. | 氯元素的非金属性比溴元素强 |
11.下列实验装置图(部分夹持装置略去)正确的是( )
| A. |  实验室制备及收集乙烯 | B. |  石油分馏 | ||
| C. |  实验室制硝基苯 | D. |  用于分离乙醇和水 |
1.下列性质可以证明化合物内一定存在离子键的是( )
| A. | 含有金属元素 | B. | 具有较高的熔点 | C. | 水溶液能导电 | D. | 熔融状态能导电 |
5.设NA为阿伏加德罗常数的值,则下列关于3.8g由T35Cl与T232S组成的混合气体中含有的粒子数错误的是( )
| A. | 质子数为1.8NA | B. | 分子数为0.1NA | C. | 中子数为2NA | D. | 原子数为2.5NA |
20.某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素.该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
(1)该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是Ⅱ 和Ⅲ,实验结论是其他因素不变,固体表面积越大,反应速率越快;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
(2)实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是Ⅱ 和Ⅲ,实验结论是其他因素不变,固体表面积越大,反应速率越快;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
