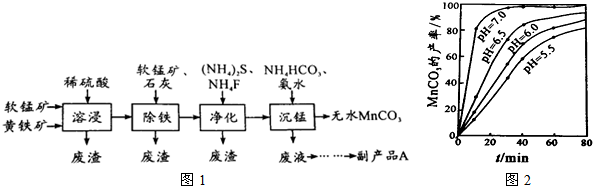
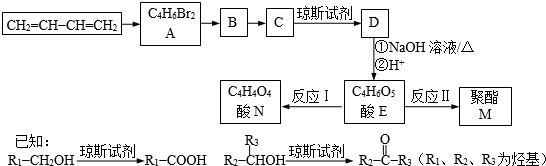
题目内容
下列表述正确的是( )
| A、常温下pH=1的一元酸和pH=13的一元碱等体积混合所得溶液一定呈中性 |
| B、常温下,pH=7的氨水与氯化铵的混合溶液中,Cl-与NH4+的浓度关系c(Cl-)>c(NH4+) |
| C、10mL 0.10mol?L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是C(Na+)>C(CH3COO-)>C(OH-)>C(H+) |
| D、中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡
专题:
分析:A.常温下,pH=1的一元酸可能是强酸或弱酸,pH=13一元碱可能是强碱或弱碱,等体积混合后,如果是强酸、强碱,则溶液呈中性,如果是弱酸、强碱,则溶液呈酸性,如果是强酸、弱碱,则混合溶液呈碱性;
B.常温下pH=7的溶液中存在C(OH-)=C(H+),根据电荷守恒判断c(Cl-)、c(NH4+)相对大小;
C.等物质的量的醋酸和NaOH恰好反应生成醋酸钠,醋酸钠溶液呈碱性,再结合电荷守恒判断C(Na+)、C(CH3COO-)相对大小;
D.pH相等的HCl和醋酸,醋酸浓度大于盐酸,中和等体积、等pH的HCl溶液和CH3COOH溶液所消耗NaOH的物质的量与酸的物质的量成正比.
B.常温下pH=7的溶液中存在C(OH-)=C(H+),根据电荷守恒判断c(Cl-)、c(NH4+)相对大小;
C.等物质的量的醋酸和NaOH恰好反应生成醋酸钠,醋酸钠溶液呈碱性,再结合电荷守恒判断C(Na+)、C(CH3COO-)相对大小;
D.pH相等的HCl和醋酸,醋酸浓度大于盐酸,中和等体积、等pH的HCl溶液和CH3COOH溶液所消耗NaOH的物质的量与酸的物质的量成正比.
解答:
解:A.常温下,pH=1的一元酸可能是强酸或弱酸,pH=13一元碱可能是强碱或弱碱,等体积混合后,如果是强酸、强碱,则溶液呈中性,如果是弱酸、强碱,则溶液呈酸性,如果是强酸、弱碱,则混合溶液呈碱性,所以二者混合溶液不一定呈中性,故A错误;
B.常温下pH=7的溶液中存在C(OH-)=C(H+),根据电荷守恒得c(Cl-)=c(NH4+),故B错误;
C.等物质的量的醋酸和NaOH恰好反应生成醋酸钠,醋酸根离子水解导致醋酸钠溶液呈碱性则C(OH-)>C(H+),根据电荷守恒得C(Na+)>C(CH3COO-),盐类水解较微弱,所以离子浓度大小顺序是C(Na+)>C(CH3COO-)>C(OH-)>C(H+),故C正确;
D.pH相等的HCl和醋酸,醋酸浓度大于盐酸,所以等体积等pH的盐酸和醋酸,醋酸的物质的量大于盐酸,中和等体积、等pH的HCl溶液和CH3COOH溶液所消耗NaOH的物质的量与酸的物质的量成正比,所以醋酸消耗NaOH的物质的量多,故D错误;
故选C.
B.常温下pH=7的溶液中存在C(OH-)=C(H+),根据电荷守恒得c(Cl-)=c(NH4+),故B错误;
C.等物质的量的醋酸和NaOH恰好反应生成醋酸钠,醋酸根离子水解导致醋酸钠溶液呈碱性则C(OH-)>C(H+),根据电荷守恒得C(Na+)>C(CH3COO-),盐类水解较微弱,所以离子浓度大小顺序是C(Na+)>C(CH3COO-)>C(OH-)>C(H+),故C正确;
D.pH相等的HCl和醋酸,醋酸浓度大于盐酸,所以等体积等pH的盐酸和醋酸,醋酸的物质的量大于盐酸,中和等体积、等pH的HCl溶液和CH3COOH溶液所消耗NaOH的物质的量与酸的物质的量成正比,所以醋酸消耗NaOH的物质的量多,故D错误;
故选C.
点评:本题考查弱电解质的电离、离子浓度大小比较,侧重考查分析能力,明确溶液中的溶质及其性质是解本题关键,注意结合守恒思想解答,题目难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
下列有关原子结构和元素周期律表述正确的是( )
| A、原子序数为15的元素的最高化合价为+3 |
| B、第ⅦA族元素是同周期中非金属性最强的元素 |
| C、Li、Na、K、Rb、Cs的得电子能力逐渐增强 |
| D、原子序数为12的元素位于元素周期表的第三周期的ⅡA族 |
Al粉投入某无色澄清的溶液中产生H2,则下列离子组合正确的是( )
| A、H+、Ca2+、Na+、CO32- |
| B、Mg2+、Al3+、SO42-、Cl- |
| C、Cu2+、Mg2+、Cl-、OH- |
| D、K+、Na+、OH-、SO42- |
下列离子方式书写正确的是( )
| A、NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、向稀Fe(NO3)2和NaBr混合溶液中滴加稀盐酸6Br-+8H++2NO3-=3Br2+2NO↑+4H2O |
| C、Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- |
| D、双氧水使酸性KMnO4溶液褪色2MnO4-+5H2O2=2Mn2++5O2↑+6OH-+2H2O |
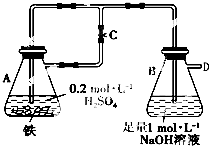 铁是人类应用较早,当前应用量最大的金属元素.
铁是人类应用较早,当前应用量最大的金属元素.