题目内容
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3).其工业流程如下:
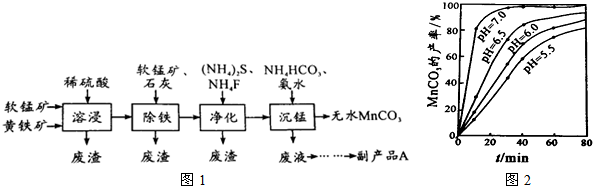
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) .
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是(用离子方程式表示) .
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(F-)=0.01mol?L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05mol?L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图2所示.根据图中信息得出的结论是 .
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是 .
(6)从沉锰工序中得到纯净MnCO3的操作方法是 ,沉锰工序中怎样证明MnCO3已经洗涤干净 ,副产品A的化学式是 .

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条)
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是(用离子方程式表示)
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(F-)=0.01mol?L-1,滤液中残留的c(Ca2+)=
(4)沉锰工序中,298K、c(Mn2+)为1.05mol?L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图2所示.根据图中信息得出的结论是
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是
(6)从沉锰工序中得到纯净MnCO3的操作方法是
考点:制备实验方案的设计
专题:实验设计题
分析:(1)通过搅拌、适当升高温度、研磨矿石、适当增大酸的浓度等,可以提高溶浸工序中原料的浸出率;
(2)主要成分是FeS2的黄铁矿在酸浸过程中产生亚铁离子,因此流程第二步除铁环节的铁应该转化铁离子才能更好除去,所以需要加入氧化剂软锰矿使残余的Fe2+转化为Fe3+;
(3)由于流程第二步加入了石灰引入了Ca2+杂质,因此除去溶液中的Cu2+、Ca2+等杂质可分别使用(NH4)2S和NH4F,生成CuS、CaF沉淀除去,根据已知氟化钙的溶度积和c(F-),可求c(Ca2+);
(4)根据沉锰的图象可知,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果;
(5)沉锰工序的溶液中有Mn2+,加入碳酸氢铵,Mn2+会与HCO3-电离产生的CO32-结合成难溶的沉淀MnCO3,从而促进HCO3-进一步电离产生H+,一部分HCO3-又与电离得到的H+反应生成气体CO2,据此写出反应的化学方程式;
(6)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、洗涤、干燥即可得到碳酸锰;可根据MnCO3的难溶性验证是否洗涤干净;得到的滤液中还有大量的铵根离子和硫酸根离子没有反应,据此判断副产品.
(2)主要成分是FeS2的黄铁矿在酸浸过程中产生亚铁离子,因此流程第二步除铁环节的铁应该转化铁离子才能更好除去,所以需要加入氧化剂软锰矿使残余的Fe2+转化为Fe3+;
(3)由于流程第二步加入了石灰引入了Ca2+杂质,因此除去溶液中的Cu2+、Ca2+等杂质可分别使用(NH4)2S和NH4F,生成CuS、CaF沉淀除去,根据已知氟化钙的溶度积和c(F-),可求c(Ca2+);
(4)根据沉锰的图象可知,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果;
(5)沉锰工序的溶液中有Mn2+,加入碳酸氢铵,Mn2+会与HCO3-电离产生的CO32-结合成难溶的沉淀MnCO3,从而促进HCO3-进一步电离产生H+,一部分HCO3-又与电离得到的H+反应生成气体CO2,据此写出反应的化学方程式;
(6)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、洗涤、干燥即可得到碳酸锰;可根据MnCO3的难溶性验证是否洗涤干净;得到的滤液中还有大量的铵根离子和硫酸根离子没有反应,据此判断副产品.
解答:
解:(1)提高浸取率的措施可以是搅拌、适当升高温度、研磨矿石、适当增大酸的浓度等,
故答案为:搅拌、适当升高温度、研磨矿石、适当提高稀硫酸的浓度;
(2)主要成分是FeS2的黄铁矿在酸浸过程中产生亚铁离子,因此流程第二步除铁环节的铁应该转化铁离子才能更好除去,所以需要加入氧化剂软锰矿使残余的Fe2+转化为Fe3+,离子方程式为MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O,再加入石灰调节pH值使Fe3+完全沉淀,
故答案为:MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O;
(3)由于流程第二步加入了石灰引入了Ca2+杂质,因此除去溶液中的Cu2+、Ca2+等杂质可分别使用(NH4)2S和NH4F,生成CuS、CaF沉淀除去,根据已知氟化钙的溶度积和c(F-)可知:c(Ca2+)=
=
=1.46×10-6mol?L-1,
故答案为:1.46×10-6mol?L-1;
(4)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3的产率最高;
(5)沉锰工序的溶液中有Mn2+,加入碳酸氢铵,Mn2+会与HCO3-电离产生的CO32-结合成难溶的沉淀MnCO3,从而促进HCO3-进一步电离产生H+,一部分HCO3-又与电离得到的H+反应生成气体CO2,因此整个反应可以表达成Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(6)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、洗涤、干燥即可;可根据MnCO3的难溶性验证是否洗涤干净,方法为:取最后一次洗涤液少量于试管中,加入过量盐酸,再滴加少量BaCl2溶液,振荡,无沉淀产生,则已洗涤干净;得到的滤液中还有大量的铵根离子和硫酸根离子没有反应,因此可以制的副产品为:(NH4)2SO4,
故答案为:过滤、洗涤、干燥;取最后一次洗涤液少量于试管中,加入过量盐酸,再滴加少量BaCl2溶液,振荡,无沉淀产生,则已洗涤干净;(NH4)2SO4.
故答案为:搅拌、适当升高温度、研磨矿石、适当提高稀硫酸的浓度;
(2)主要成分是FeS2的黄铁矿在酸浸过程中产生亚铁离子,因此流程第二步除铁环节的铁应该转化铁离子才能更好除去,所以需要加入氧化剂软锰矿使残余的Fe2+转化为Fe3+,离子方程式为MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O,再加入石灰调节pH值使Fe3+完全沉淀,
故答案为:MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O;
(3)由于流程第二步加入了石灰引入了Ca2+杂质,因此除去溶液中的Cu2+、Ca2+等杂质可分别使用(NH4)2S和NH4F,生成CuS、CaF沉淀除去,根据已知氟化钙的溶度积和c(F-)可知:c(Ca2+)=
| Ksp(CaF2) |
| c2(F-) |
| 1.46×10-10 |
| 0.012 |
故答案为:1.46×10-6mol?L-1;
(4)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3的产率最高;
(5)沉锰工序的溶液中有Mn2+,加入碳酸氢铵,Mn2+会与HCO3-电离产生的CO32-结合成难溶的沉淀MnCO3,从而促进HCO3-进一步电离产生H+,一部分HCO3-又与电离得到的H+反应生成气体CO2,因此整个反应可以表达成Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(6)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、洗涤、干燥即可;可根据MnCO3的难溶性验证是否洗涤干净,方法为:取最后一次洗涤液少量于试管中,加入过量盐酸,再滴加少量BaCl2溶液,振荡,无沉淀产生,则已洗涤干净;得到的滤液中还有大量的铵根离子和硫酸根离子没有反应,因此可以制的副产品为:(NH4)2SO4,
故答案为:过滤、洗涤、干燥;取最后一次洗涤液少量于试管中,加入过量盐酸,再滴加少量BaCl2溶液,振荡,无沉淀产生,则已洗涤干净;(NH4)2SO4.
点评:本题通过碳酸锰的制备,考查了物质制备实验方案的设计方法,题目难度较大,明确制备流程及相应的反应原理为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
理论上不能用于设计成原电池的反应是( )
| A、2H2(g)+O2(g)═2H2O(l)△H<0 |
| B、HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0 |
| C、2Al(s)+3Cl2(g)═2AlCl3(s)△H<0 |
| D、Zn(s)+2HCl(aq)═ZnCl2+H2(g)△H<0 |
下列表述正确的是( )
| A、常温下pH=1的一元酸和pH=13的一元碱等体积混合所得溶液一定呈中性 |
| B、常温下,pH=7的氨水与氯化铵的混合溶液中,Cl-与NH4+的浓度关系c(Cl-)>c(NH4+) |
| C、10mL 0.10mol?L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是C(Na+)>C(CH3COO-)>C(OH-)>C(H+) |
| D、中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
下列除去杂质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
| B | Al2O3 | Fe2O3 | 盐酸 | 过滤 |
| C | KBr溶液 | Br2 | KOH溶液 | 分液 |
| D | Cl2 | HCl | 饱和食盐水 | 洗气 |
| A、A | B、B | C、C | D、D |
下列说法中不正确的是( )
| A、HCl的相对分子质量与6.02×1023个HCl分子的质量(以g为单位)在数值上相等 |
| B、6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 |
| C、32 g氧气所含的原子数目为2×6.02×1023 |
| D、常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2 L |
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
| A、NaOH、H2SO4、Ba(OH)2 |
| B、NaOH、CuSO4、H2SO4 |
| C、HCl、CuCl2、Ba(OH)2 |
| D、NaBr、H2SO4、Ba(OH)2 |

