题目内容
19.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的有( )①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④正反应速率一定大于逆反应速率
⑤反应物的浓度一定降低
⑥使用了合适的催化剂.
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 影响化学平衡移动的因素有浓度、温度、压强等,外界条件不同,对平衡移动的影响不同,改变条件使化学平衡向正反应方向移动,则正反应速率一定大于逆反应速率,生成物的产量一定增加.
解答 解:①生成物的质量分数不一定增加,如合成氨,减小氨的量平衡正向移动,生成物的质量分数减少,故错误;
②平衡正向移动,生成物的产量一定增加,故正确;
③两种反应物的反应,增大一种物质的量,提高另一种物质的转化率,本身转化率减小,所以反应物的转化率不一定增大,故错误;
④平衡正向移动的本质是正反应速率一定大于逆反应速率,故正确;
⑤增大反应物浓度,平衡移动的结果是减弱,而不是抵消,增大的反应物,达新平衡状态反应物的浓度比原来浓度大,所以反应物的浓度不一定降低,故错误;
⑥使用了合适的催化剂,平衡不移动,故错误;故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
9.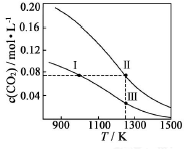 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ) | |
| C. | 体系中c(CO2):c(CO2,状态Ⅱ)<3c(CO2,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
7.常温下,下列有关离子浓度及pH大小的比较正确的是( )
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积和混合,其离子浓度不可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的 pH>7 | |
| D. | pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13.7 |
11.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2 LCO2所含的分子数为0.5NA | |
| B. | 标准状况下,22.4 L 酒精中所含分子数为NA | |
| C. | 标准状况下,18g H2O所含原子数为NA | |
| D. | 常温常压下,48g O2与O3混合物含有的氧原子数为3NA |
8.下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法.其中正确的是( )
| 选项 | A | B | C | D |
| 物质 | KNO3溶液 | CO2 | 水 | 乙醇 |
| 杂质 | KOH | H2O(g) | 溴 | 水 |
| 除杂试剂 | FeCl3溶液 | 浓硫酸 | 酒精 | 生石灰 |
| 除杂装置 | 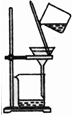 | 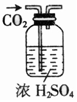 | 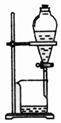 | 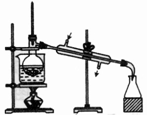 |
| A. | A | B. | B | C. | C | D. | D |
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.