题目内容
中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化.回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器除大、小烧杯及温度计外还有: 、 .在大、小烧杯之间填满碎泡沫的作用是 .
(2)该实验常用0.50mol?L-1 HCl和0.55mol?L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是 .当室温低于10℃时进行,对实验结果会造成较大的误差其原因是 .
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g?℃),则该中和反应放出热量为 kJ(填表达式).
(1)中学化学实验中的中和热的测定所需的玻璃仪器除大、小烧杯及温度计外还有:
(2)该实验常用0.50mol?L-1 HCl和0.55mol?L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g?℃),则该中和反应放出热量为
考点:中和热的测定
专题:实验题
分析:(1)根据量热计的构造和实验步骤来确定实验的仪器;中和热测定实验成败的关键是保温工作;
(2)为了保证HCl完全反应,碱应过量;温度过低,散热加快,对实验结过造成的误差较大;
(3)根据中和热计算公式Q=cm△T进行解答;
(2)为了保证HCl完全反应,碱应过量;温度过低,散热加快,对实验结过造成的误差较大;
(3)根据中和热计算公式Q=cm△T进行解答;
解答:
解:(1)中学化学实验中的中和热的测定,需要量筒量取酸碱的体积、需要环形玻璃搅拌棒搅拌溶液使之混合均匀;大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,
故答案为:量筒、环形玻璃搅拌棒;保温、隔热、减少实验过程中热量的损失;
(2)NaOH的浓度大于HCl的浓度,使盐酸完全被中和;当室温低于10℃时进行,散热加快,对实验结过造成的误差较大;
故答案为:保证盐酸完全被中和;散热太快;
(3)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,溶液的质量为100ml×1g/cm3=100g,温度变化的值△T为(t2-t1)℃,则生成0.025mol水放出的热量为Q=m?c?△T=100g×4.18J/(g?℃)×(t2-t1)℃=418(t2-t1)J=0.418(t2-t1)kJ;
故答案为:0.418(t2-t1);
故答案为:量筒、环形玻璃搅拌棒;保温、隔热、减少实验过程中热量的损失;
(2)NaOH的浓度大于HCl的浓度,使盐酸完全被中和;当室温低于10℃时进行,散热加快,对实验结过造成的误差较大;
故答案为:保证盐酸完全被中和;散热太快;
(3)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,溶液的质量为100ml×1g/cm3=100g,温度变化的值△T为(t2-t1)℃,则生成0.025mol水放出的热量为Q=m?c?△T=100g×4.18J/(g?℃)×(t2-t1)℃=418(t2-t1)J=0.418(t2-t1)kJ;
故答案为:0.418(t2-t1);
点评:本题考查热反应热的测定与计算,题目难度大,注意理解中和热的概念以及测定反应热的原理等问题.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
在含Fe3+的溶液中加入铜粉与铁粉,充分反应后发现溶液中存在Cu2+,下列说法错误的是( )
| A、容器中已肯定无Fe粉存在 |
| B、容器中可能有Cu粉存在 |
| C、溶液中Fe2+比Cu2+多 |
| D、溶液中肯定不存在Fe3+ |
取等质量的铝粉分别与足量的稀硫酸或氢氧化钠溶液反应,所得氢气的体积在同样条件下相比( )
| A、与酸反应产生的氢气多 |
| B、与碱反应产生的氢气多 |
| C、一样多 |
| D、不知道铝粉的质量,无法比较 |
下列说法错误的是( )
| A、制取肥皂时,常常加入少量乙醇,目的是加快皂化反应 |
B、海水提镁的主要步骤为: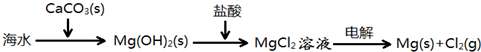 |
| C、工业上将二氧化碳和氨气通入食盐水中制的碳酸氢钠,再煅烧碳酸氢钠使其转化为碳酸钠 |
| D、用蒸馏法便可分离苯和溴苯 |

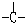 和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.
和一个-Cl,它可能的结构有四种,试写出其中的三种结构简式.