题目内容
13.废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是BD(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1.
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+..
分析 (1)根据环境保护时不会产生污染环境的因素来判断;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据图示信息,当温度升高时反应速率加快来回答;
(4)根据反应物和生成物来书写离子反应.
解答 解:(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ•mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ•mol-1;
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)H3=-285.84KJ•mol-1;
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×$\frac{1}{2}$+③得到,
由盖斯定律可知该反应的反应热△H=H1+H2×$\frac{1}{2}$+H3=64.39KJ•mol-1+(-196.46KJ•mol-1)×$\frac{1}{2}$+(-285.84KJ•mol-1)=-319.68KJ.mol-1,
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1;
(3)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,
故答案为:H2O2分解速率加快;
(4)根据题干信息,可知发生的反应为2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+.
点评 本题考查热化学方程式和盖斯定律计算应用,铜的化合物的性质,是一道综合题目,难度中等,要求学生具有分析和解决问题的能力.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案| A. | 苯的邻位二元取代物只有一种 | B. | 苯的间位二元取代物只有一种 | ||
| C. | 苯的对位二元取代物只有一种 | D. | 苯的邻位二元取代物有二种 |
| A. |  转移溶液 | B. | 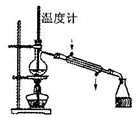 制蒸馏水 制蒸馏水 | C. | 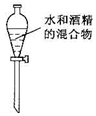 分离水喝酒精 | D. | 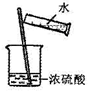 稀释浓硫酸 |
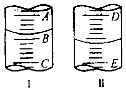
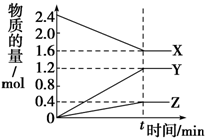 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.(1)该反应的化学方程式是2X?3Y+Z
(2)根据化学反应2A(g)+5B (g)?4C(g),填写下表中的空白
| A | B | C | |
| 反应开始时浓度(mol/L) | 4.8 | 0 | |
| 2min后的浓度(mol/L) | 1.2 | 0.8 | |
| 2min内的浓度的变化(mol/L) | 0.4 | ||
| 化学学反应速率[mol/(L•min)] | 0.5 |
 某课外小组欲鉴定某硫酸钠样品中是否含有亚硫酸钠,设计方案如下:取少量固体配成溶液,往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色.如果溶液紫色褪去,说明该样品中含有亚硫酸钠.
某课外小组欲鉴定某硫酸钠样品中是否含有亚硫酸钠,设计方案如下:取少量固体配成溶液,往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色.如果溶液紫色褪去,说明该样品中含有亚硫酸钠.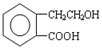 ,它可通过不同化学反应分别制得B、C和D 三种物质.
,它可通过不同化学反应分别制得B、C和D 三种物质.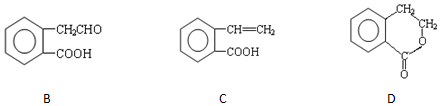
 +H2O
+H2O
 .
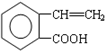
.

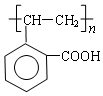 .
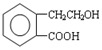
.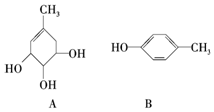 A、B的结构简式如图:
A、B的结构简式如图: