题目内容
2.(1)常温下,0.1mol/L的醋酸和0.1mol/L的盐酸各100mL,分别与足量的锌粒反应,产生的气体体积前者=后者(填“<”“>”或“=”).(2)常温下,0.1mol/L的醋酸和pH=1的醋酸各100mL,分别与足量的锌粒反应,产生的气体前者比后者少.(填多或少)
(3)在25℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字母,下同)D.
A.5 B.7 C.3~5之间 D.5~7之间
(4)25℃时,向0.1mol/L的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将A.
A.增大 B.减小 C.不变 D.无法确定
(5)室温下,向0.1mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又不影响H2的体积,可以向硫酸溶液中加入B试剂.
A.碳酸钠晶体 B.醋酸钠晶体 C.滴加1mol/L的H2SO4溶液.
分析 (1)醋酸和盐酸都是一元酸,足量的锌和酸反应生成氢气的体积与酸的物质的量成正比;
(2)醋酸是弱电解质,溶液中存在电离平衡,与足量金属反应生成气体的体积与酸的物质的量成正比;
(3)氯化铵溶液加水稀释促进其水解,但酸性减弱;
(4)醋酸钠能够抑制醋酸的电离;
(5)减小氢离子浓度但不能减少氢离子总量可以达到目的.
解答 解:(1)醋酸和盐酸都是一元酸,等体积等浓度的醋酸和盐酸的物质的量相等,分别与足量的锌反应生成氢气的体积与酸的物质的量成正比,醋酸和酸的物质的相等所以生成氢气的体积相等,
故答案为:=;
(2)醋酸是弱电解质,所以醋酸溶液中存在电离平衡,醋酸的浓度大于其溶液中氢离子浓度,所以常温下,0.1mol•L-1的醋酸和pH=1的醋酸中前者浓度小于后者,二者各100mL分别与足量的锌粒反应,产生的气体体积与醋酸的物质的量成正比,前者的物质的量小于后者,所以前者比后者少,故答案为:少;
(3)氯化铵溶液加水稀释促进其水解,但酸性减弱,pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH在5~7之间,故答案为:D;
(4)醋酸钠能够抑制醋酸的电离,向0.1mol/L的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将增大,故答案为:A;
(5)减小氢离子浓度但不能减少氢离子总量,可以加入醋酸钠生成醋酸分子或加水稀释,故答案为:B.
点评 本题考查了影响化学反应速率的因素,主要考虑了浓度、弱电解质的电离平衡、盐类水解平衡、原电池原理,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.在生产和生活中,人们广泛利用着化学反应释放的能量.下列说法正确的是( )
| A. | 中和反应时并不一定都伴随着能量变化 | |
| B. | 所有的燃烧反应都是放热反应 | |
| C. | 只要有能量变化的都是化学变化 | |
| D. | 任何反应中的能量变化都表现为热量变化 |
13.废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是BD(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1.
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是H2O2分解速率加快.
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+..
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是BD(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1.
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+..
7.在Na2S溶液中下列关系不正确( )
| A. | c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | B. | c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | ||
| C. | c(Na+)>c(S2-)>c(OH-)>c(HS-) | D. | c(OH-)=c(H+)+c(HS-)+c(H2S) |
14.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A. | 第一电离能:Y一定小于X | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 最高价含氧酸的酸性:X对应的酸性强于Y对应的 | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |


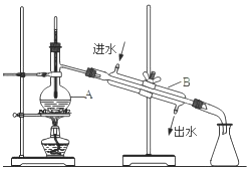 如图为实验室制备蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制备蒸馏水的装置示意图,根据图示回答下列问题.