题目内容
19.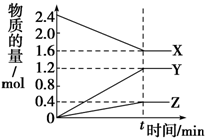 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.(1)该反应的化学方程式是2X?3Y+Z
(2)根据化学反应2A(g)+5B (g)?4C(g),填写下表中的空白
| A | B | C | |
| 反应开始时浓度(mol/L) | 4.8 | 0 | |
| 2min后的浓度(mol/L) | 1.2 | 0.8 | |
| 2min内的浓度的变化(mol/L) | 0.4 | ||
| 化学学反应速率[mol/(L•min)] | 0.5 |
分析 (1)图象知,从0~t时刻,n(X)减小,n(Y)增大,n(Z)增大,可知X为反应物,Y、Z为生成物,△n(X):△n(Y):△n(Z)=0.8:1.2:0.4=2:3:1,t时刻达到平衡状态,故该反应的化学方程式为:2X?3Y+Z,
(2)2A(g)+5B (g)?4C(g),
开始 4.8 0
转化 0.4 1 0.8
2min 1.2 3.8 0.8
开始浓度=转化的浓度+2min时浓度、结合v=$\frac{△c}{△t}$解答.
解答 解:(1)由图象知,从0~t时刻,n(X)减小,n(Y)增大,n(Z)增大,可以确定X为反应物,Y、Z为生成物,△n(X):△n(Y):△n(Z)=0.8:1.2:0.4=2:3:1,t时刻达到平衡状态,故该反应的化学方程式为:2X?3Y+Z,
故答案为:2X?3Y+Z;
(2)2A(g)+5B (g)?4C(g),
开始 4.8 0
转化 0.4 1 0.8
2min 1.2 3.8 0.8
A的开始浓度为1.2+0.4=1.6mol/L,B转化的浓度为1mol/L,B后来浓度为3.8mol/L,C浓度变化为0.8mol/L,
A的反应速率为$\frac{0.4mol/L}{2min}$=0.2mol/(L•min),C的反应速率为$\frac{0.8mol/L}{2min}$=0.4mol/(L•min),
故答案为:
| A | B | C | |
| 反应开始时浓度(mol/L) | 1.6 | 4.8 | 0 |
| 2min后的浓度(mol/L) | 1.2 | 3.8 | 0.8 |
| 2min内的浓度的变化(mol/L) | 0.4 | 1.0 | 0.8 |
| 化学学反应速率[mol/(L•min)] | 0.2 | 0.5 | 0.4 |
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、反应的确定、速率及浓度的计算为解答的关键,侧重分析与应用能力的考查,注意判断变化量,题目难度不大.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是BD(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1.
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+..
| A. | 第一电离能:Y一定小于X | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 最高价含氧酸的酸性:X对应的酸性强于Y对应的 | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
Ⅰ.若在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生反应:CO(g)+2H2(g)?CH3OH(g).测得平衡时CO的转化率随温度及压强的变化如图1所示.p2、195℃时,n(H2)随时间的变化如表所示.
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
(2)你认为p1<p2;p2、195℃时,B点,v(正)<v(逆)(填“<”“>”或“=”).
(3)p2、195℃时,该反应的化学平衡常数为25.
Ⅱ.NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如图2:
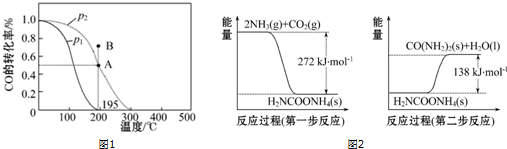
(1)NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ•mol-1.
(2)工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有D(填序号).
A.升高温度 B.加入催化剂
C.将尿素及时分离出去 D.增大反应体系的压强.

 焦炭与CO、H2均是重要的能源,也是重要的化工原料.
焦炭与CO、H2均是重要的能源,也是重要的化工原料.
 如图为实验室制备蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制备蒸馏水的装置示意图,根据图示回答下列问题. 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).
水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).