题目内容
1.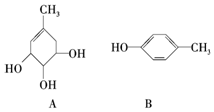 A、B的结构简式如图:
A、B的结构简式如图:(1)A分子中含有的官能团的名称是醇羟基、碳碳双键;B分子中含有的官能团的名称是酚羟基.
(2)A能否与氢氧化钠溶液反应不能;B能否与氢氧化钠溶液反应能.
(3)A在一定条件下可得到B,其反应类型和条件分别是消去反应、浓硫酸、加热.
(4)A、B各1mol分别加入足量溴水,完全反应后消耗单质溴的物质的量分别是1mol,2mol.
分析 (1)A中含有官能团是碳碳双键和醇羟基;B中官能团是酚羟基;
(2)卤代烃、酚、羧酸、酯都能和NaOH溶液反应;
(3)A发生消去反应可以得到B,需要浓硫酸作催化剂、加热条件;
(4)A中只有碳碳双键能和溴发生加成反应,B中苯环上酚羟基邻对位氢原子能和溴发生取代反应.
解答 解:(1)A中含有官能团是碳碳双键和醇羟基;B中官能团是酚羟基,
故答案为:(醇)羟基、碳碳双键;(酚)羟基;
(2)卤代烃、酚、羧酸、酯都能和NaOH溶液反应,A中不含卤原子、酚羟基、羧基、酯基,所以不能和NaOH溶液反应,B中含有酚羟基能和NaOH反应,故答案为:不能;能;
(3)A发生消去反应可以得到B,需要浓硫酸作催化剂、加热条件;
故答案为:消去反应; 浓硫酸、加热;
(4)A中只有碳碳双键能和溴发生加成反应,B中苯环上酚羟基邻对位氢原子能和溴发生取代反应,所以A能与1mol溴反应,B能和2mol溴发生取代反应,故答案为:1;2.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,注意A中不含酚羟基,为易错点.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
11.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应有关的是( )
①氢氧化钠的表面发生潮解
②充有氢气的气球遇明火爆炸
③铁制菜刀生锈
④铜铸塑像上出现铜绿[Cu2(OH)2CO3]
⑤维生素C帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+
⑥浓硫酸久置体积变大⑦澄清石灰水变浑浊.
①氢氧化钠的表面发生潮解
②充有氢气的气球遇明火爆炸
③铁制菜刀生锈
④铜铸塑像上出现铜绿[Cu2(OH)2CO3]
⑤维生素C帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+
⑥浓硫酸久置体积变大⑦澄清石灰水变浑浊.
| A. | ①②③④ | B. | ②③④⑤ | C. | ③④⑤⑥ | D. | ④⑤⑥⑦ |
12.在生产和生活中,人们广泛利用着化学反应释放的能量.下列说法正确的是( )
| A. | 中和反应时并不一定都伴随着能量变化 | |
| B. | 所有的燃烧反应都是放热反应 | |
| C. | 只要有能量变化的都是化学变化 | |
| D. | 任何反应中的能量变化都表现为热量变化 |
9.下列各组物质中,不能使用分液漏斗进行分离的是( )
| A. | 甲苯和水 | B. | 氯乙烷和水 | C. | 硝基苯和水 | D. | 单质溴和溴苯 |
6.已知:CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如表:
试回答下列问题
(1)上述化学变化的逆向反应是:吸热 反应(选填:放热、吸热).
(2)800℃发生上述反应,以表中的物质的量投入恒容反应器,
其中向正向移动的有BCE(选填A、B、C、D、E).
(3)已知在一定温度下:C(s)+CO2(g)?2CO(g)△H1平衡常数K;
C(s)+H2O(g)?CO(g)+H2(g)△H2平衡常数K1;
CO(g)+H2O(g)?H2(g)+CO2(g)△H3平衡常数K2,
则K、K1、K2之间的关系是:$\frac{{K}_{1}}{{K}_{2}}$.
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:75%.
(5)若800℃进行,设起始时CO和H2O(g)共5mol,水蒸气体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=x.(用含x的代数式表达)
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
(1)上述化学变化的逆向反应是:吸热 反应(选填:放热、吸热).
(2)800℃发生上述反应,以表中的物质的量投入恒容反应器,
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(3)已知在一定温度下:C(s)+CO2(g)?2CO(g)△H1平衡常数K;
C(s)+H2O(g)?CO(g)+H2(g)△H2平衡常数K1;
CO(g)+H2O(g)?H2(g)+CO2(g)△H3平衡常数K2,
则K、K1、K2之间的关系是:$\frac{{K}_{1}}{{K}_{2}}$.
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:75%.
(5)若800℃进行,设起始时CO和H2O(g)共5mol,水蒸气体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=x.(用含x的代数式表达)
13.废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是BD(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1.
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是H2O2分解速率加快.
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+..
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是BD(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1.
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+..
