题目内容
本题是关于石灰石并与之相关的一些问题,请按要求回答:
(1)向漂白粉溶液中通入过量的二氧化碳后,在300℃灼烧至固体质量不再变化,最终所得固体为: (填名称)
(2)一定温度下,某真空密闭容器中投入碳酸钙,发生反应CaCO3(s)?CaO(s)+CO2(g),达到平衡后,现将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为
A、不变 B、减小 C、增大为原来的2倍 D、比原来大,但比2倍小
(3)已知实验室制备甲烷气体的原理是利用无水醋酸钠与碱石灰共热:CH3COONa+NaOH
CH4↑+Na2CO3,请写出C6H5COONa与碱石灰共热的化学反应方程式 .
(4)某种胃药中止酸剂为CaCO3.为测定其中CaCO3含量,某研究小组设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).
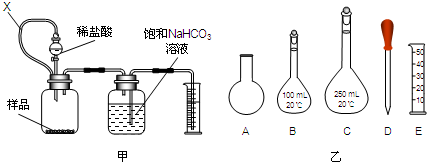
方案一:用如图甲装置测量一定量样品与足量稀盐酸反应生成CO2的体积,计算CaCO3的含量;装置中连通管X的作用是平衡分液漏斗与样品瓶内的压强,使液体能顺利留下,另一作用为 .
方案二:用滴定法测定,操作步骤为:
A.配制0.100mol/L HCl溶液与0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
D.以酚酞为指示剂,用0.100mol/L NaOH溶液滴定,用去体积为V mL达到终点
①现需要重复滴定4次,配制0.1mol/L HCl溶液需要选用如图乙所示仪器中的 (填字母).
②经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO3的质量分数为 .
③与方案一相比,方案二的主要优点是 .
(1)向漂白粉溶液中通入过量的二氧化碳后,在300℃灼烧至固体质量不再变化,最终所得固体为:
(2)一定温度下,某真空密闭容器中投入碳酸钙,发生反应CaCO3(s)?CaO(s)+CO2(g),达到平衡后,现将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为
A、不变 B、减小 C、增大为原来的2倍 D、比原来大,但比2倍小
(3)已知实验室制备甲烷气体的原理是利用无水醋酸钠与碱石灰共热:CH3COONa+NaOH
| CaO |
| △ |
(4)某种胃药中止酸剂为CaCO3.为测定其中CaCO3含量,某研究小组设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).
方案一:用如图甲装置测量一定量样品与足量稀盐酸反应生成CO2的体积,计算CaCO3的含量;装置中连通管X的作用是平衡分液漏斗与样品瓶内的压强,使液体能顺利留下,另一作用为
方案二:用滴定法测定,操作步骤为:

A.配制0.100mol/L HCl溶液与0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
D.以酚酞为指示剂,用0.100mol/L NaOH溶液滴定,用去体积为V mL达到终点
①现需要重复滴定4次,配制0.1mol/L HCl溶液需要选用如图乙所示仪器中的
②经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO3的质量分数为
③与方案一相比,方案二的主要优点是
考点:探究物质的组成或测量物质的含量,化学平衡的影响因素
专题:
分析:(1)漂白粉的水溶液中通入足量的CO2生成碳酸氢钙和次氯酸,碳酸氢钙、次氯酸受热分解,氯化氢挥发;
(2)温度不变,化学平衡常数不变,则二氧化碳浓度不变;
(3)根据甲烷气体的原理是利用无水醋酸钠与碱石灰共热:CH3COONa+NaOH
CH4↑+Na2CO3,类比写出C6H5COONa与碱石灰共热的化学反应方程式;
(4)方案一:由于实验一般在密闭环境下进行,滴入一定液体后会发生内外压不平衡情况,此时液体就不易滴下,采用连通管可平衡内外压帮助液体顺利滴下;本实验是通过计算CO2量反推CaCO3的量,所以气体的量是否精准决定了实验的成功与否,由于滴下液体时,广口瓶中原有的气体也会相应进入集气瓶中,这样会使CO2量偏大,采用连通管可使这部分气体回到分液漏斗中,不进入集气瓶中,减小实验误差.
方案二:①因为每次滴定用的盐酸是25.00 mL,重复操作4 次,再加上润洗滴定管、调零、赶气泡也需消耗盐酸,则所需盐酸大于100 mL,故配制时需用250 mL的容量瓶,定容时需要用胶头滴管,而加水稀释时也可以借助量筒来量水的量;
②反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑计算碳酸钙的质量,再根据质量分数定义计算;
③与方案一相比,方案二的优点是滴定法所需样品和试剂量少,实验测定结果误差小.
(2)温度不变,化学平衡常数不变,则二氧化碳浓度不变;
(3)根据甲烷气体的原理是利用无水醋酸钠与碱石灰共热:CH3COONa+NaOH
| CaO |
| △ |
(4)方案一:由于实验一般在密闭环境下进行,滴入一定液体后会发生内外压不平衡情况,此时液体就不易滴下,采用连通管可平衡内外压帮助液体顺利滴下;本实验是通过计算CO2量反推CaCO3的量,所以气体的量是否精准决定了实验的成功与否,由于滴下液体时,广口瓶中原有的气体也会相应进入集气瓶中,这样会使CO2量偏大,采用连通管可使这部分气体回到分液漏斗中,不进入集气瓶中,减小实验误差.
方案二:①因为每次滴定用的盐酸是25.00 mL,重复操作4 次,再加上润洗滴定管、调零、赶气泡也需消耗盐酸,则所需盐酸大于100 mL,故配制时需用250 mL的容量瓶,定容时需要用胶头滴管,而加水稀释时也可以借助量筒来量水的量;
②反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑计算碳酸钙的质量,再根据质量分数定义计算;
③与方案一相比,方案二的优点是滴定法所需样品和试剂量少,实验测定结果误差小.
解答:
解:(1)漂白粉的水溶液中通入足量的CO2生成碳酸氢钙和次氯酸,加热蒸干、灼烧,碳酸氢钙、次氯酸受热分解,氯化氢挥发;残留固体为碳酸钙和氯化钙,
故答案为:碳酸钙、氯化钙;
(2)温度不变,化学平衡常数不变,K=c(CO2),则二氧化碳浓度不变,故选A;
(3)根据甲烷气体的原理是利用无水醋酸钠与碱石灰共热:CH3COONa+NaOH
CH4↑+Na2CO3,反应的特点是羧酸钠中的-COONa被氢氧化钠中H取代,
类比写出C6H5COONa与碱石灰共热的化学反应方程式为:C6H5COONa+NaOH
 +Na2CO3;C6H5COONa+NaOH
+Na2CO3;C6H5COONa+NaOH
 +Na2CO3;
+Na2CO3;
(4)方案1:由于实验一般在密闭环境下进行,滴入一定液体后会发生内外压不平衡情况,此时液体就不易滴下,采用连通管可平衡内外压帮助液体顺利滴下;本实验是通过计算CO2量反推CaCO3的量,所以气体的量是否精准决定了实验的成功与否,由于滴下液体时,广口瓶中原有的气体也会相应进入集气瓶中,这样会使CO2量偏大,采用连通管可使这部分气体回到分液漏斗中,不进入集气瓶中,减小实验误差.
故答案为:消除滴入盐酸体积对所测气体体积的影响.
方案二:①因为每次滴定用的盐酸是25.00 mL,重复操作4 次,再加上润洗滴定管、调零、赶气泡也需消耗盐酸,则所需盐酸大于100 mL,故配制时需用250 mL的容量瓶,定容时需要用胶头滴管,而加水稀释时也可以借助量筒来量水的量,故选:CDE.
②反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑可知,100g:2mol=m(CaCO3):0.100 mol/L×0.012L,解得:m=0.06 g,碳酸钙的质量分数为
×100%=60%.故答案为:60%.
③与方案一相比,方案二的优点是滴定法所需样品和试剂量少,实验测定结果误差小,故答案为:滴定法所需样品和试剂量少,实验测定结果误差小.
故答案为:碳酸钙、氯化钙;
(2)温度不变,化学平衡常数不变,K=c(CO2),则二氧化碳浓度不变,故选A;
(3)根据甲烷气体的原理是利用无水醋酸钠与碱石灰共热:CH3COONa+NaOH
| CaO |
| △ |
类比写出C6H5COONa与碱石灰共热的化学反应方程式为:C6H5COONa+NaOH
| CaO |
| △ |
 +Na2CO3;C6H5COONa+NaOH
+Na2CO3;C6H5COONa+NaOH| CaO |
| △ |
 +Na2CO3;
+Na2CO3;(4)方案1:由于实验一般在密闭环境下进行,滴入一定液体后会发生内外压不平衡情况,此时液体就不易滴下,采用连通管可平衡内外压帮助液体顺利滴下;本实验是通过计算CO2量反推CaCO3的量,所以气体的量是否精准决定了实验的成功与否,由于滴下液体时,广口瓶中原有的气体也会相应进入集气瓶中,这样会使CO2量偏大,采用连通管可使这部分气体回到分液漏斗中,不进入集气瓶中,减小实验误差.
故答案为:消除滴入盐酸体积对所测气体体积的影响.
方案二:①因为每次滴定用的盐酸是25.00 mL,重复操作4 次,再加上润洗滴定管、调零、赶气泡也需消耗盐酸,则所需盐酸大于100 mL,故配制时需用250 mL的容量瓶,定容时需要用胶头滴管,而加水稀释时也可以借助量筒来量水的量,故选:CDE.
②反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑可知,100g:2mol=m(CaCO3):0.100 mol/L×0.012L,解得:m=0.06 g,碳酸钙的质量分数为
| 0.06g |
| 0.1g |
③与方案一相比,方案二的优点是滴定法所需样品和试剂量少,实验测定结果误差小,故答案为:滴定法所需样品和试剂量少,实验测定结果误差小.
点评:本题考查方程式的书写、平衡原理应用、对实验原理的理解与实验操作评价、物质含量测定、滴定原理利用,化学计算等,难度中等,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.注意化学平衡常数和气体浓度之间的关系.

练习册系列答案
相关题目
 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.
 如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: