题目内容
某研究性学习小组同学将一定浓度的NaHCO3溶液加入到CuSO4溶液中,发现生成了沉淀他们对沉淀的成分进行了如下探究,请填写相关内容:
提出假设
假设1:沉淀全部是CuCO3;
假设2: ;
假设3:沉淀是CuCO3和Cu(OH)2的混合物.
验证假设:
(1)如果假设1成立,则反应的离子方程式为 .
用离子方程式表示假设3中可能有Cu(OH)2沉淀生成的依据: .
(2)为了证明哪种假设成立,该小组同学首先将所得沉淀过滤、洗涤、低温干燥,并进行了如下两个实验:
A、 (填操作和现象),
结论:假设2不成立;假设1或假设3正确.
B、利用如图所示装置对沉淀中CuCO3的质量分数进行测定:
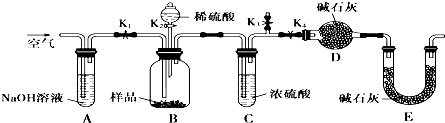
①实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.关闭K2、K3,打开K1、K4,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确顺序是(填选项序号,下同) .若未进行步骤 ,将使结果偏低.
②若沉淀样品的质量为10.0g,装置D的质量增加了2.9g,则沉淀中CuCO3的质量分数为 .
③由以上实验可知,假设 成立.
提出假设
假设1:沉淀全部是CuCO3;
假设2:
假设3:沉淀是CuCO3和Cu(OH)2的混合物.
验证假设:
(1)如果假设1成立,则反应的离子方程式为
用离子方程式表示假设3中可能有Cu(OH)2沉淀生成的依据:
(2)为了证明哪种假设成立,该小组同学首先将所得沉淀过滤、洗涤、低温干燥,并进行了如下两个实验:
A、
结论:假设2不成立;假设1或假设3正确.
B、利用如图所示装置对沉淀中CuCO3的质量分数进行测定:

①实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.关闭K2、K3,打开K1、K4,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确顺序是(填选项序号,下同)
②若沉淀样品的质量为10.0g,装置D的质量增加了2.9g,则沉淀中CuCO3的质量分数为
③由以上实验可知,假设
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)依据沉淀为氢氧化铜、碳酸铜或二者混合物假设判断,若生成碳酸铜说明是铜离子结合碳酸根离子,促进碳酸氢根离子电离;假设3可逆含有氢氧化铜,生成的氢氧化铜的原因是因为碳酸氢根离子水解显碱性,铜离子水解显酸性,二者水解相互促进生成氢氧化铜和二氧化碳;
(2)假设2不成立;假设1或假设3正确,加入盐酸反应生成二氧化碳验证;
实验目的为测定沉淀中CuCO3的质量分数,由实验装置可知,A中NaOH溶液吸收二氧化碳,开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应,故应关闭K1、K3,打开K2、K4,反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,否则会导致二氧化碳测定的质量偏低,测定碳酸铜的质量分数偏低;而E装置可防止空气的二氧化碳、水进入装置D中,影响质量分数的测定,以此来解答.
(2)假设2不成立;假设1或假设3正确,加入盐酸反应生成二氧化碳验证;
实验目的为测定沉淀中CuCO3的质量分数,由实验装置可知,A中NaOH溶液吸收二氧化碳,开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应,故应关闭K1、K3,打开K2、K4,反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,否则会导致二氧化碳测定的质量偏低,测定碳酸铜的质量分数偏低;而E装置可防止空气的二氧化碳、水进入装置D中,影响质量分数的测定,以此来解答.
解答:
解:依据假设可知沉淀可逆是碳酸铜或氢氧化铜或二者混合物,假设2沉淀全部为Cu(OH)2,故答案为:沉淀全部是Cu(OH)2;
(1)若假设1正确,若生成碳酸铜说明是铜离子结合碳酸根离子,促进碳酸氢根离子电离,反应的离子方程式为Cu2++2HCO3-═=CuCO3↓+H2O+CO2↑;
假设3中可能有Cu(OH)2沉淀生成的依据为生成氢氧化铜沉淀使利用铜离子和碳酸氢根离子双水解生成:H2O+HCO3-?H2CO3+OH- 或Cu2++2HCO3-=Cu(OH)2↓+2CO2↑;
故答案为:Cu2++2HCO3-═CuCO3↓+H2O+CO2↑;H2O+HCO3-?H2CO3+OH- 或Cu2++2HCO3-=Cu(OH)2↓+2CO2↑;
(2)假设2不成立;假设1或假设3正确,取少量样品于试管,滴加足量稀硫酸或盐酸,沉淀全部溶解,有气泡产生证明含有碳酸铜;
故答案为:取少量样品于试管,滴加足量稀硫酸或盐酸,沉淀全部溶解,有气泡产生;
①由实验目的及装置可知,开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应;故应关闭K1、K3,打开K2、K4;反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,故正确的顺序是cab;
反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,否则会导致二氧化碳测定的质量偏低,测定碳酸铜的质量分数偏低,
故答案为:cab;b;
②装置D的质量增加的2.9g为反应生成的二氧化碳的质量,二氧化碳的物质的量为=
=0.066mol,根据碳元素守恒可知n(CuCO3)=n(CO2)=0.066mol,故碳酸铜的质量为0.066mol×124g/mol=8.17g,故沉淀中CuCO3的质量分数为
×100%=81.7%;
故答案为:81.7%;
③沉淀质量分数假设可知含有氢氧化铜沉淀,所以假设3正确,故答案为:3.
(1)若假设1正确,若生成碳酸铜说明是铜离子结合碳酸根离子,促进碳酸氢根离子电离,反应的离子方程式为Cu2++2HCO3-═=CuCO3↓+H2O+CO2↑;
假设3中可能有Cu(OH)2沉淀生成的依据为生成氢氧化铜沉淀使利用铜离子和碳酸氢根离子双水解生成:H2O+HCO3-?H2CO3+OH- 或Cu2++2HCO3-=Cu(OH)2↓+2CO2↑;
故答案为:Cu2++2HCO3-═CuCO3↓+H2O+CO2↑;H2O+HCO3-?H2CO3+OH- 或Cu2++2HCO3-=Cu(OH)2↓+2CO2↑;
(2)假设2不成立;假设1或假设3正确,取少量样品于试管,滴加足量稀硫酸或盐酸,沉淀全部溶解,有气泡产生证明含有碳酸铜;
故答案为:取少量样品于试管,滴加足量稀硫酸或盐酸,沉淀全部溶解,有气泡产生;
①由实验目的及装置可知,开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应;故应关闭K1、K3,打开K2、K4;反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,故正确的顺序是cab;
反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,否则会导致二氧化碳测定的质量偏低,测定碳酸铜的质量分数偏低,
故答案为:cab;b;
②装置D的质量增加的2.9g为反应生成的二氧化碳的质量,二氧化碳的物质的量为=
| 2.9g |
| 44g/mol |
| 8.17g |
| 10g |
故答案为:81.7%;
③沉淀质量分数假设可知含有氢氧化铜沉淀,所以假设3正确,故答案为:3.
点评:本题考查物质含量的测定及性质实验方案设计,为高频考点,把握实验原理与装置的理解评价、对实验操作的理解、物质含量的测定、化学计算等为解答的关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与分析问题、解决问题能力,题目难度中等.

练习册系列答案
相关题目
几种短周期元素的原子半径及主要化合价见表,下列叙述正确的是( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A、在RCl2中,各原子最外层均满足8电子的稳定结构 |
| B、元素L和N性质相似因为处于同一主族 |
| C、K、M、Q三元素最高价氧化物对应的水化物两两之间可发生化学反应 |
| D、氢化物沸点:H2Q>H2T |
分子式为C5H10O3的有机物,在一定条件下能发生如下反应:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在特定温度及浓硫酸存在下,能生成一种能使溴水褪色的物质;③在特定温度及浓硫酸存在下,还能生成一种分子式为C5H8O2的五元环状化合物.则C5H10O3的结构简式为( )
| A、HOCH2CH2COOCH2CH3 |
| B、HOCH2CH2CH2CH2COOH |
| C、CH3CH2CH(OH)CH2COOH |
| D、CH3CH(OH)CH2CH2COOH |
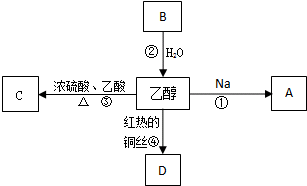 2011年5月1日起,《中华人民共和国刑法修正案(八)》正式实施,醉酒驾驶作为危险驾驶罪被追究驾驶人刑事责任.醉酒驾驶的界定标准为:每百毫升血液中的酒精含量高于或等于80毫克,相当于3两低度白酒或者2瓶啤酒.乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物,其中B是烃.
2011年5月1日起,《中华人民共和国刑法修正案(八)》正式实施,醉酒驾驶作为危险驾驶罪被追究驾驶人刑事责任.醉酒驾驶的界定标准为:每百毫升血液中的酒精含量高于或等于80毫克,相当于3两低度白酒或者2瓶啤酒.乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物,其中B是烃.
 (R表示烃基),请回答下列问题:
(R表示烃基),请回答下列问题: