题目内容
4.某温度下,碳酸钠、碳酸氢钠的溶解度分别为:21.2g、9.6g.现有该温度下的碳酸钠饱和溶液84.8g,向其中通入过量的二氧化碳气体.设反应前、后溶液温度不发生变化,反应后溶液密度近似为1g/cm3,则反应后所得溶液的物质的量浓度约为( )| A. | 3mol/L | B. | 2mol/L | C. | 1mol/L | D. | 无法计算 |
分析 CO2通入Na2CO3溶液中,发生Na2CO3+CO2+H2O=2NaHCO3,Na2CO3溶解度为21.2g,NaHCO3溶解度为9.6g,通入二氧化碳后会生成沉淀NaHCO3,所以溶液为碳酸氢钠的饱和溶液,根据碳酸氢钠的溶解度计算n(NaHCO3)和c(NaHCO3).
解答 解:CO2通入Na2CO3溶液中,发生Na2CO3+CO2+H2O=2NaHCO3,Na2CO3溶解度为21.2g,NaHCO3溶解度为9.6g,通入二氧化碳后会生成沉淀NaHCO3,所以溶液为碳酸氢钠的饱和溶液,已知100g水中最多溶解碳酸氢钠为9.6g,则n(NaHCO3)=$\frac{9.6g}{84g/mol}$,溶液的体积为V=$\frac{m}{ρ}$=$\frac{100+9.6}{1}$mL,
则c(NaHCO3)=$\frac{\frac{9.6}{84}mol}{0.1096L}$≈1mol/L,
故选C.
点评 本题考查物质的量的相关计算,题目难度中等,侧重于学生的分析能力和计算能力的考查,本题注意通过溶解度可知通入二氧化碳会生成碳酸氢钠晶体,溶液仍是饱和溶液.

练习册系列答案
相关题目
14.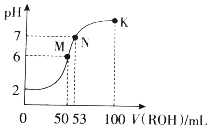 在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
 在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )| A. | ROH为一元弱碱 | |
| B. | M点溶液呈酸性的原因是R++H2O?ROH+H+ | |
| C. | M、N、K三点水的电离程度逐渐减小 | |
| D. | K点溶液中离子浓度c(Cl-)>c(R+)>c(OH-)>c(H+) |
19.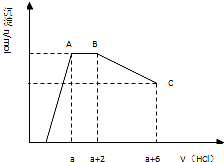 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )| A. | 溶液中一定不存在的离子:Fe3+,Mg2+,Al3+ | |
| B. | AB段可得到能使澄清的石灰水变浑浊的气体 | |
| C. | c(CO32-):c(AlO2-)=2:3 | |
| D. | BC段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O |
9.将标准状况下3360mL SO2气体通入100mL2mol/L的NaOH溶液中充分反应,所得溶液的溶质组成是( )
| A. | Na2SO3 | B. | NaHSO3 | C. | Na2SO3和NaHSO3 | D. | NaOH和Na2SO3 |
16.常温下,关于pH=10的氨水和氢氧化钠溶液,下列说法正确的是( )
| A. | n(NH3•H2O)>n(NaOH) | |
| B. | 在氢氧化钠溶液中,c(OH)=1010mol/L | |
| C. | 在氨水中,c(OH)=c(NH4)+c(H) | |
| D. | 0.1mol/L的盐酸分别与等体积的氨水和氢氧化钠溶液恰好完全反应,氨水消耗的盐酸体积少 |
13.5.6g铁粉投入到足量的100mL 2mol/L的稀硫酸中,2min时铁粉刚好溶解,下列表示这个反应的速率正确的是( )
| A. | v(H2SO4)=0.5 mol/(L•min) | B. | v(H2SO4)=1 mol/(L•min) | ||
| C. | v(H+)=0.5 mol/(L•min) | D. | v(FeSO4)=0.5 mol/(L•min) |
14.室温条件下,下列有关电解质溶液的描述正确是( )
| A. | 向Na2CO3溶液中通入CO2至溶液为中性,则$\frac{c({{N}_{a}}^{+})}{2c(C{{O}_{3}}^{2-})}$>1 | |
| B. | pH相同的氨水和Ba(OH)2溶液中2c(NH4+)=c(Ba2+) | |
| C. | 将CH3COONa溶液从25℃升温至40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| D. | 向Mg(OH)2浊液中加入少量NH4Cl粉末,$\frac{c(M{g}^{2+})}{c(O{H}^{-})}$不变 |