题目内容
6.现有一铁、硅、铝的混合物13g,当与足量盐酸反应时,生成标准状况下的氢气的体积为11.2L;若使等质量的混合物与足量的氢氧化钠溶液反应时,生成的氢气在标准状况下也是11.2L,求原混合物中各成分的质量.分析 设出混合物中Fe、Al、Si的物质的量,硅不与盐酸反应,铁不与氢氧化钠溶液反应,根据电子守恒计算出生成氢气的量,然后分别根据总质量及生成氢气的量列式计算即可.
解答 解:设混合物中Fe、Al、Si的物质的量分别为x、y、z,则①56x+27y+28z=13,
标准状况下11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
Si不与盐酸反应,根据电子守恒可得:②2x+3y=0.5×2,
Fe不与NaOH溶液反应,根据电子守恒可得:③4z+3y=0.5×2,
联立①②③可得:x=$\frac{1}{13}$mol、y=$\frac{11}{39}$mol,z=$\frac{1}{26}$mol,
该混合物中含有Fe的质量为:$\frac{1}{13}$mol×56g/mol≈4.3g,含有Al的质量为:27g/mol×$\frac{11}{39}$mol≈7.6g,含有Si的质量为:28g/mol×$\frac{1}{26}$mol≈1.1g,
答:原混合物中含有4.3gFe、7.6gAl、1.1gSi.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 制备单晶硅的过程中不发生氧化还原反应 | |
| B. | 绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 氢氧化铝可作胃酸的中和剂 |
14.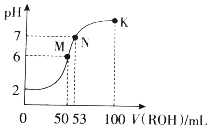 在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
 在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )| A. | ROH为一元弱碱 | |
| B. | M点溶液呈酸性的原因是R++H2O?ROH+H+ | |
| C. | M、N、K三点水的电离程度逐渐减小 | |
| D. | K点溶液中离子浓度c(Cl-)>c(R+)>c(OH-)>c(H+) |
1.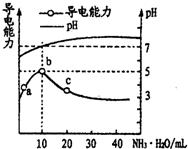 常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )
 常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )| A. | a→b点导电能力增强,说明HR为弱酸 | |
| B. | b点溶液的pH=5,此时酸碱恰好中和 | |
| C. | c点溶液存在c(OH-)>c(H+) | |
| D. | a、b、c三点NH3•H2O的电离常数均相等 |
11.电对Zn2+/Zn加入氨水后,其电极电势将( )
| A. | 减小 | B. | 增大 | C. | 不变 | D. | 无法确定 |
18.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、澄清溶液的是( )
| A. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | B. | NH4+、Ba2+、OH-、NO3-(1:1:1:2) | ||
| C. | K+、H+、I-、AlO2-(1:1:1:1) | D. | Na+、Al3+、Cl-、OH-(4:1:4:3) |
16.常温下,关于pH=10的氨水和氢氧化钠溶液,下列说法正确的是( )
| A. | n(NH3•H2O)>n(NaOH) | |
| B. | 在氢氧化钠溶液中,c(OH)=1010mol/L | |
| C. | 在氨水中,c(OH)=c(NH4)+c(H) | |
| D. | 0.1mol/L的盐酸分别与等体积的氨水和氢氧化钠溶液恰好完全反应,氨水消耗的盐酸体积少 |