题目内容
11. 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.(1)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气高温反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②除去烟气中的SO2,下列物质可作洗涤剂的是ab(填字母).
a.NaOH b.Na2CO3 c.CaCl2 d.NaHSO3
(2)已知汽车发动机工作时汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H=+183kJ•mol-1.
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8.0×10-4mol.该温度下的平衡常数K=4×10-6(科学计数法表示,保留两位有效数字).
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量
增大的原因:该反应是吸热反应,温度升高,反应速率加快,平衡向正反应方向移动,因此单位时间内NO排放量增大.
(3)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
①写出该反应的离子方程式SO2+I2+2H2O=SO42-+2I-+4H+.
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是增大SO2与碘水的接触面积,使SO2和碘水充分反应.
③洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量偏低(填“偏高”、“偏低”或“无影响”).
(4)将某PM2.5样本用蒸馏水处理制成待测试液.
若测得该试液所含水溶性无机离子的化学组分及其平均浓度[c(H+)、c(OH-)待测]如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)①写出热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H,利用盖斯定律计算反应热;
②二氧化硫是酸性氧化物,能与和碱或强碱弱酸盐溶液反应;
(2)计算出平衡时各种物质的物质的量,计算平衡浓度,结合平衡常数的表达式计算;
(3)方案利用的原理为:SO2+I2+2H2O=H2SO4+2HI,据此确定二氧化硫的物质的量,进而定尾气中二氧化硫的含量;
①方案利用的原理为:SO2+I2+2H2O=H2SO4+2HI,改写为离子方程式;
②洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
③洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大;
(4)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性.
解答 解:(1)①已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g)△H=(-110.51kJ•mol-1)-(-241.81kJ•mol-1)=+13l.3 kJ•mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3 kJ•mol-1;
②洗涤含SO2的烟气,是一种酸性氧化物,能与氢氧化钠反应,由于亚硫酸的酸性大于碳酸而小于盐酸,所以二氧化硫可以与Na2CO3 反应,而与CaCl2 和NaHSO3不反应,
故答案为:ab;
(2)计算平衡常数时,先计算物质的平衡量,N2为0.8mol-4×10-4 mol,O2为0.2mol-4×10-4 mol,带入平衡常数表达式即可,得K=4×10-6,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移,
故答案为:4×10-6;该反应是吸热反应,温度升高,反应速率加快,平衡向正反应方向移动,因此单位时间内NO排放量增大;
(3)甲方案利用的原理为:SO2+I2+2H2O=H2SO4+2HI,最后测定剩余气体的体积,进而定尾气中二氧化硫的含量;
①方案利用的原理为:SO2+I2+2H2O=H2SO4+2HI,离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
故答案为:增大SO2与碘水的接触面积,使SO2和碘水充分反应;
③洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,因此SO2含量偏低;
故答案为:偏低;
(4)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性,
故答案为:酸性.
点评 该题综合考查化学反应原理的基础知识、水的电离平衡和溶液酸碱性的关系,涉及离子的水解、盖斯定律的应用、化学平衡常数的计算,题目难度中等,注意相关知识的积累.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | a×b×18×6.02×1023 | B. | $\frac{18b}{a}$×6.02×1023 | ||
| C. | $\frac{18a}{b}$×6.02×1023 | D. | $\frac{b}{18a}$×6.02×1023 |
| A. | 钠 | B. | 生石灰 | C. | 无水硫酸铜 | D. | 电石 |
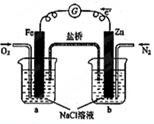
| A. | 向烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成 | |
| B. | 烧杯b中发生反应为Zn+2e-=Zn2+ | |
| C. | 电子从Zn极流出,流入Fe极,经盐桥回到Zn极 | |
| D. | 烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
| A. | 溶液中水电离出的c(H+)=10-10 mol•L-1 | |
| B. | 溶液中c(H+)+c(A-)=0.1 mol•L-1 | |
| C. | 与0.05 mol•L-1 NaOH溶液等体积混合,水的电离平衡向正向移动 | |
| D. | 上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大 |
| A. | c(HA)<c(A-) | B. | c(Na+)=c(A-)+c(HA) | ||
| C. | c(HA)-c(A-)=c(OH-) | D. | c(HA)+c(A-)=0.1mol/L |
| A. | 1mL pH=10的氨水和100mLpH=4的甲酸溶液导电性相同 | |
| B. | pH均为5的HCl和NH4Cl溶液中,水的电离程度相同 | |
| C. | 稀释pH=10的氨水,溶液中所有离子的浓度均降低 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
 .
.
 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.