题目内容
6.如表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: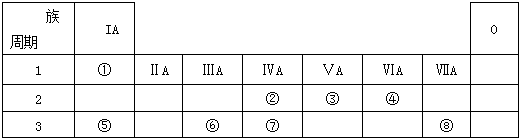
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 .
.(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
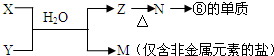
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,N→⑥的单质的化学方程式为2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
分析 由元素在周期表中的位置、可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(2)同一周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,符合条件的有NaOH、NaClO、NaClO3等;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2;
(5)M是仅含非金属的盐所以一定是铵盐,Z$\stackrel{△}{→}$N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝,Z是氢氧化铝,由产物及转化X+Y+H2O→Al(OH)3+NH4+ 可知该反应为铝盐和一水合氨的反应.
解答 解:由元素在周期表中的位置、可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,
故答案为:Na>Al>O;
(2)②③是C、N,是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HNO3>H2CO3,②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,符合条件的有NaOH、NaClO、NaClO3等,NaOH的电子式为 ,故答案为:
,故答案为: ;
;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z$\stackrel{△}{→}$N→⑥的单质;根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,由产物及X+Y+H2O→Al(OH)3+NH4+可知该反应是铝盐和一水合氨的反应,所以X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,N→⑥的单质的化学方程式为2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查位置、结构与性质的关系,为高频考点,涉及元素周期表与元素周期律的综合应用,题目难度中等,注意掌握元素周期律内容、元素周期表结构,试题培养学生灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案正确的是( )
| 选项 | X溶液 | 固体Y | Z溶液 | 现象 |  |
| A | 稀硫酸 | 亚硫酸氢钠 | 品红试剂 | 品红褪色 | |
| B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
| C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
| D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
| A. | A | B. | B | C. | C | D. | D |
 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.(1)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气高温反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②除去烟气中的SO2,下列物质可作洗涤剂的是ab(填字母).
a.NaOH b.Na2CO3 c.CaCl2 d.NaHSO3
(2)已知汽车发动机工作时汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H=+183kJ•mol-1.
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8.0×10-4mol.该温度下的平衡常数K=4×10-6(科学计数法表示,保留两位有效数字).
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量
增大的原因:该反应是吸热反应,温度升高,反应速率加快,平衡向正反应方向移动,因此单位时间内NO排放量增大.
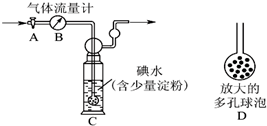
(3)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
①写出该反应的离子方程式SO2+I2+2H2O=SO42-+2I-+4H+.
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是增大SO2与碘水的接触面积,使SO2和碘水充分反应.
③洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量偏低(填“偏高”、“偏低”或“无影响”).
(4)将某PM2.5样本用蒸馏水处理制成待测试液.
若测得该试液所含水溶性无机离子的化学组分及其平均浓度[c(H+)、c(OH-)待测]如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

| A. | △H>0 | B. | △H<0 | C. | △H=0 | D. | 无法判断 |
| A. | 该反应的还原剂是Cl- | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |