题目内容
3.将0.2mol•L-1HA溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的( )| A. | c(HA)<c(A-) | B. | c(Na+)=c(A-)+c(HA) | ||
| C. | c(HA)-c(A-)=c(OH-) | D. | c(HA)+c(A-)=0.1mol/L |
分析 将0.2 mol•L-1 HA溶液和0.1 mol•L-1的NaOH溶液等体积混合后,所得溶液中c(HA)=0.05 mol•L-1,c(NaA)=0.05 mol•L-1,由于混合后溶液呈碱性,则c(OH-)>c(H+),说明NaA水解程度大于HA的电离程度,结合电荷守恒c(H+)+c(Na+)=c(A-)+c(OH-)和物料守恒2c(Na+)=c(A-)+c(HA)解答该题.
解答 解:A.混合后得溶液中c(HA)=0.05 mol•L-1,c(NaA)=0.05 mol•L-1,溶液呈碱性,说明NaA水解程度大于HA的电离程度,故c(HA)>c(A-),故A错误;
B.反应后溶液中c(HA)=0.05 mol•L-1,c(NaA)=0.05 mol•L-1,根据物料守恒可得:2c(Na+)=c(A-)+c(HA),故B错误;
C.由物料守恒可知:2c(Na+)=c(A-)+c(HA),根据电荷守恒可得:c(H+)+c(Na+)=c(A-)+c(OH-),二者结合可得:2c(H+)+c(HA)+c(A-)=2c(A-)+2c(OH-),则2c(H+)+c(HA)=c(A-)+2c(OH-),c(HA)-c(A-)=2c(OH-)-2c(H+),故C错误;
D.由反应后溶质的物料守恒可得:c(HA)+c(A-)=0.1mol•L-1,故D正确;
故选D.
点评 本题考查了混合溶液中离子浓度大小的判断,为高考常见题型,题目难度中等,试题侧重于学生的分析能力的考查,注意电荷守恒和物料守恒的运用,把握盐类水解的特点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.可用作磁性材料的物质是( )
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeS |
11. 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.
(1)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气高温反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②除去烟气中的SO2,下列物质可作洗涤剂的是ab(填字母).
a.NaOH b.Na2CO3 c.CaCl2 d.NaHSO3
(2)已知汽车发动机工作时汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H=+183kJ•mol-1.
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8.0×10-4mol.该温度下的平衡常数K=4×10-6(科学计数法表示,保留两位有效数字).
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量
增大的原因:该反应是吸热反应,温度升高,反应速率加快,平衡向正反应方向移动,因此单位时间内NO排放量增大.
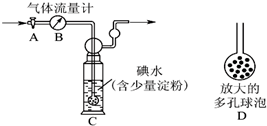
(3)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
①写出该反应的离子方程式SO2+I2+2H2O=SO42-+2I-+4H+.
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是增大SO2与碘水的接触面积,使SO2和碘水充分反应.
③洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量偏低(填“偏高”、“偏低”或“无影响”).
(4)将某PM2.5样本用蒸馏水处理制成待测试液.
若测得该试液所含水溶性无机离子的化学组分及其平均浓度[c(H+)、c(OH-)待测]如表:
根据表中数据判断该待测试液酸碱性为酸性.(填“酸性”、“中性”、“碱性”或“不确定”)
 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.(1)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气高温反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②除去烟气中的SO2,下列物质可作洗涤剂的是ab(填字母).
a.NaOH b.Na2CO3 c.CaCl2 d.NaHSO3
(2)已知汽车发动机工作时汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H=+183kJ•mol-1.
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8.0×10-4mol.该温度下的平衡常数K=4×10-6(科学计数法表示,保留两位有效数字).
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量
增大的原因:该反应是吸热反应,温度升高,反应速率加快,平衡向正反应方向移动,因此单位时间内NO排放量增大.
(3)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
①写出该反应的离子方程式SO2+I2+2H2O=SO42-+2I-+4H+.
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是增大SO2与碘水的接触面积,使SO2和碘水充分反应.
③洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量偏低(填“偏高”、“偏低”或“无影响”).
(4)将某PM2.5样本用蒸馏水处理制成待测试液.
若测得该试液所含水溶性无机离子的化学组分及其平均浓度[c(H+)、c(OH-)待测]如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
18.某反应过程中的能量变化如图所示,则该反应的△H为( )


| A. | △H>0 | B. | △H<0 | C. | △H=0 | D. | 无法判断 |
15.某离子反应中涉及H2O、ClO?、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )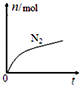

| A. | 该反应的还原剂是Cl- | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
12.(1)不同温度下水的离子积常数如表所示:
请用文字解释随温度升高水的离子积增大的原因:水电离吸热,升高温度后平衡正向移动;
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
向NaCN溶液中通入少量CO2,所发生反应的化学方程式为CO2+H2O+NaCN═NaHCO3+HCN.
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
13.下列说法中正确的是( )
| A. | 制作航天服的聚脂纤维是新型无机非金属材料 | |
| B. | 肥皂可以用来去油污 | |
| C. | 金属的腐蚀属于物理变化 | |
| D. | 煤的气化属于化学变化 |