题目内容
已知常温下Mg(OH)2的Ksp=1.8×10-11.若某氢氧化镁溶液的pH=9,则该溶液中c(Mg2+)最大为( )
| A、0.18mol/L |
| B、1.8×10-2 mol/L |
| C、1.8×10-6 mol/L |
| D、2.0×10-10mol/L |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:已知常温下Mg(OH)2的Ksp=1.8×10-11,pH=9的氢氧化镁溶液中c(OH-)=10-5mol/L,根据Ksp=c(Mg2+)?c2(OH-)计算.
解答:
解:已知常温下Mg(OH)2的Ksp=1.8×10-11,pH=9的氢氧化镁溶液中c(OH-)=10-5mol/L,Ksp=c(Mg2+)?c2(OH-),
则c(Mg2+)=
=
=0.18mol/L,
故选A.
则c(Mg2+)=
| Ksp |
| c2(OH-) |
| 1.8×10-11 |
| (10-5)2 |
故选A.
点评:本题考查了溶度积常数的有关计算,侧重于基本公式的应用的考查,题目难度不大,把握Ksp的计算公式即可解答.

练习册系列答案
相关题目
同质量的下列气体中,所含原子数最少的是( )
| A、CH4 |
| B、CO2 |
| C、HCl |
| D、N2 |
用石墨做电极电解500mLCuSO4溶液.通电一段时间后,测定两极均产生2.24L气体(标准状况下,忽略气体溶解),则CuSO4溶液的物质的量浓度为( )
| A、0.4 mol.L-1 |
| B、0.2 mol.L-1 |
| C、0.3 mol.L-1 |
| D、0.05mol.L-1 |
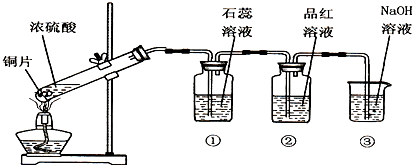

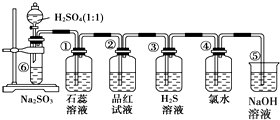 如图是实验室制备SO2并验证SO2某些性质的装置图,试回答:
如图是实验室制备SO2并验证SO2某些性质的装置图,试回答: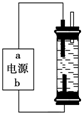 使用氯化钠作原料可以得到多种产品.
使用氯化钠作原料可以得到多种产品.