题目内容
甲、乙、丙均是常见的正盐,甲、丙由3种元素组成,乙由4种元素组成;甲、乙含有相同的阳离子A,乙、丙含有相同的阴离子B.在185~200℃时,一定量的甲完全分解产生气体X(相对分子质量为44)和3.6g H2O.分别向乙、丙的溶液中加入Ba(OH)2溶液至过量,并适当微热,乙中有不溶于盐酸的白色沉淀和无色带有刺激性气味的气体产生;丙中出现白色沉淀且沉淀部分溶解.
(1)阳离子A为 ;阴离子B为 .
(2)气体X的化学式为 ,其物质的量为 mol.
(3)乙与Ba(OH)2溶液反应的化学方程式为 .
(4)丙与过量Ba(OH)2溶液反应的离子方程式为 .
(1)阳离子A为
(2)气体X的化学式为
(3)乙与Ba(OH)2溶液反应的化学方程式为
(4)丙与过量Ba(OH)2溶液反应的离子方程式为
考点:几组未知物的检验
专题:物质检验鉴别题
分析:丙为由3种元素组成正盐,丙的溶液中加入Ba(OH)2溶液至过量,并适当微热,出现白色沉淀且沉淀部分溶解,则丙为硫酸铝;
乙中含有四种元素组成的正盐,溶液中加入Ba(OH)2溶液至过量,并适当微热,乙中有不溶于盐酸的白色沉淀和无色带有刺激性气味的气体产生,则乙为硫酸铵;
甲、乙含有相同的阳离子A,则A为铵根离子;乙、丙含有相同的阴离子B,则B为硫酸根离子;
所以甲中为铵盐,再结合甲为正盐、含有3种元素,加热分解生成气体X(相对分子质量为44)和3.6g H2O,则甲一定为硝酸铵,根据以上分析进行解答.
乙中含有四种元素组成的正盐,溶液中加入Ba(OH)2溶液至过量,并适当微热,乙中有不溶于盐酸的白色沉淀和无色带有刺激性气味的气体产生,则乙为硫酸铵;
甲、乙含有相同的阳离子A,则A为铵根离子;乙、丙含有相同的阴离子B,则B为硫酸根离子;
所以甲中为铵盐,再结合甲为正盐、含有3种元素,加热分解生成气体X(相对分子质量为44)和3.6g H2O,则甲一定为硝酸铵,根据以上分析进行解答.
解答:
解:丙为由3种元素组成正盐,丙的溶液中加入Ba(OH)2溶液至过量,并适当微热,出现白色沉淀且沉淀部分溶解,溶解的部分为氢氧化铝,不溶部分为硫酸钡,则丙为Al2(SO4)3;
乙中含有4种元素组成的正盐,溶液中加入Ba(OH)2溶液至过量,并适当微热,乙中有不溶于盐酸的白色沉淀和无色带有刺激性气味的气体产生,白色沉淀为硫酸钡,气体为氨气,则乙为(NH4)2SO4;
甲、乙含有相同的阳离子A,则A为NH4+;乙、丙含有相同的阴离子B,则B为SO42-;
所以甲中为铵盐,再结合甲为正盐、含有3种元素,加热分解生成气体X(相对分子质量为44)和3.6g H2O,相对分子量为44的气体有二氧化碳和N2O,若为二氧化碳,则甲为碳酸铵,碳酸铵中含有4种元素,不满足要求;所以XX为N2O,甲一定为NH4NO3,
(1)根据以上分析可知,A中阳离子为NH4+,B中阴离子为SO42-,故答案为:NH4+; SO42-;
(2)气体X为甲加热分解产物,相对分子量为44的N的氧化物为N2O;NH4NO3中H、N原子的数目之比为2:1,根据质量守恒定律,则N2O的物质的量为:
×
=0.1mol,
故答案为:N2O;0.1mol;
(3)乙为(NH4)2SO4,硫酸铵与Ba(OH)2溶液反应的化学方程式为:(NH4)2SO4+Ba(OH)2
BaSO4↓+2NH3↑+2H2O,
故答案为:(NH4)2SO4+Ba(OH)2
BaSO4↓+2NH3↑+2H2O;
(4)丙为Al2(SO4)3,Al2(SO4)3与过量Ba(OH)2溶液反应的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,
故答案为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O.
乙中含有4种元素组成的正盐,溶液中加入Ba(OH)2溶液至过量,并适当微热,乙中有不溶于盐酸的白色沉淀和无色带有刺激性气味的气体产生,白色沉淀为硫酸钡,气体为氨气,则乙为(NH4)2SO4;
甲、乙含有相同的阳离子A,则A为NH4+;乙、丙含有相同的阴离子B,则B为SO42-;
所以甲中为铵盐,再结合甲为正盐、含有3种元素,加热分解生成气体X(相对分子质量为44)和3.6g H2O,相对分子量为44的气体有二氧化碳和N2O,若为二氧化碳,则甲为碳酸铵,碳酸铵中含有4种元素,不满足要求;所以XX为N2O,甲一定为NH4NO3,
(1)根据以上分析可知,A中阳离子为NH4+,B中阴离子为SO42-,故答案为:NH4+; SO42-;
(2)气体X为甲加热分解产物,相对分子量为44的N的氧化物为N2O;NH4NO3中H、N原子的数目之比为2:1,根据质量守恒定律,则N2O的物质的量为:
| 1 |
| 2 |
| 3.6g |
| 18g/mol |
故答案为:N2O;0.1mol;
(3)乙为(NH4)2SO4,硫酸铵与Ba(OH)2溶液反应的化学方程式为:(NH4)2SO4+Ba(OH)2
| ||
故答案为:(NH4)2SO4+Ba(OH)2
| ||
(4)丙为Al2(SO4)3,Al2(SO4)3与过量Ba(OH)2溶液反应的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,
故答案为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O.
点评:本题考查物质的检验与鉴别,题目难度中等,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,该类试题需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、27g铝的原子最外层电子总数为NA |
| B、2.8 g N2和2.8 g CO所含电子数均为1.4NA |
| C、1L0.1mol?L-1乙酸溶液中H+数为0.1NA |
| D、标准状况下,22.4L乙醇的分子数为NA |
下列离子方程式正确的是( )
| A、向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+ |
| B、FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、向碳酸钠溶液中加入足量硫酸铝溶液:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- |
| D、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
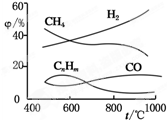 我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )
我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )| A、煤只含有碳、氢、氧三种元素 |
| B、煤中所含的有机物是CH4、CnHm、CO |
| C、温度在580~600℃范围内,CH4、CnHm分解不会生成CO |
| D、800℃以后CnHm分解生成了甲烷和氢气 |
固体X只可能由Al、(NH4)2SO4,MgCl2,FeCl2,AlCl3,AgN03中的一种或几种组成,某同学对该固体进行了如下实验:
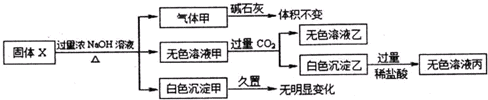
下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯挣物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 |
| D、将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应 2X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率ν(Z)=0.04mol?L-1?min-1 |
| B、其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正) |
| C、该温度下此反应的平衡常数K=90L/mol |
| D、其他条件不变,再充入0.2molZ,平衡时X的体积分数减小 |
已知常温下Mg(OH)2的Ksp=1.8×10-11.若某氢氧化镁溶液的pH=9,则该溶液中c(Mg2+)最大为( )
| A、0.18mol/L |
| B、1.8×10-2 mol/L |
| C、1.8×10-6 mol/L |
| D、2.0×10-10mol/L |
 碱金属元素在科学研究与生产生活中有着非常广泛的用途.
碱金属元素在科学研究与生产生活中有着非常广泛的用途.