题目内容
如图是产生并验证SO2某些性质的装置图.
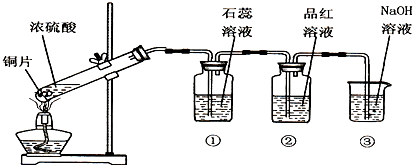
试回答:
(1)写出浓硫酸与铜反应的化学方程式 .
(2)装置①中出现的现象是 ,说明SO2的水溶液显 性.
(3)装置②中出现的现象是 ,说明SO2具有 性质.
(4)装置⑧的作用是 ,反应的离子方程式为 .

试回答:
(1)写出浓硫酸与铜反应的化学方程式
(2)装置①中出现的现象是
(3)装置②中出现的现象是
(4)装置⑧的作用是
考点:探究二氧化硫与水和品红溶液的反应
专题:实验题
分析:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,据此写出反应的化学方程式;
(2)二氧化硫能与水反应生成亚硫酸,亚硫酸使石蕊试液变红,体现了酸性氧化物的性质;
(3)二氧化硫具有漂白性,能使品红溶液褪色;
(4)为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,写出二氧化硫与氢氧根离子反应的离子方程式.
(2)二氧化硫能与水反应生成亚硫酸,亚硫酸使石蕊试液变红,体现了酸性氧化物的性质;
(3)二氧化硫具有漂白性,能使品红溶液褪色;
(4)为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,写出二氧化硫与氢氧根离子反应的离子方程式.
解答:
解:(1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(2))①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象为:溶液变成红色,说明二氧化硫的水溶液为酸性,
故答案为:溶液变成红色;酸;
(3)因二氧化硫具有漂白性,则②中的品红溶液褪色,故答案为:溶液褪色;漂白;
(4)③中盛放的是氢氧化钠溶液,其作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH-═SO32-+H2O,
故答案为:吸收二氧化硫,防止污染环境;SO2+2OH-═SO32-+H2O.
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(2))①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象为:溶液变成红色,说明二氧化硫的水溶液为酸性,
故答案为:溶液变成红色;酸;
(3)因二氧化硫具有漂白性,则②中的品红溶液褪色,故答案为:溶液褪色;漂白;
(4)③中盛放的是氢氧化钠溶液,其作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH-═SO32-+H2O,
故答案为:吸收二氧化硫,防止污染环境;SO2+2OH-═SO32-+H2O.
点评:本题考查了浓硫酸的化学性质、二氧化硫的性质及检验方法,题目难度中等,注意掌握浓硫酸、二氧化硫的化学性质,明确二氧化硫的检验方法,要求学生能够正确书写常见反应的化学方程式.

练习册系列答案
相关题目
固体X只可能由Al、(NH4)2SO4,MgCl2,FeCl2,AlCl3,AgN03中的一种或几种组成,某同学对该固体进行了如下实验:
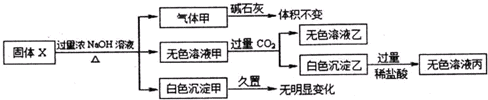
下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯挣物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 |
| D、将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应 2X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率ν(Z)=0.04mol?L-1?min-1 |
| B、其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正) |
| C、该温度下此反应的平衡常数K=90L/mol |
| D、其他条件不变,再充入0.2molZ,平衡时X的体积分数减小 |
已知常温下Mg(OH)2的Ksp=1.8×10-11.若某氢氧化镁溶液的pH=9,则该溶液中c(Mg2+)最大为( )
| A、0.18mol/L |
| B、1.8×10-2 mol/L |
| C、1.8×10-6 mol/L |
| D、2.0×10-10mol/L |
 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子X、Cl-、OH-、NO3-、CO32-中的一种.
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子X、Cl-、OH-、NO3-、CO32-中的一种.