题目内容
 使用氯化钠作原料可以得到多种产品.
使用氯化钠作原料可以得到多种产品.①实验室用惰性电极电解100mL 0.1mol?L-1 NaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的物质的量浓度是
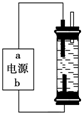
②某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置.对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
③实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.某同学利用如图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色.该同学换上的电解材料是
考点:电解原理
专题:电化学专题
分析:①根据反应物、产物写出相应的电解方程式,根据方程式进行计算;
②电解池中,阳极是阴离子放电,阴极是阳离子放电,氯气能和氢氧化钠反应生成次氯酸钠,可以制得有较强杀菌能力的消毒液;
③铁作阳极,阳极上铁失电子发生氧化反应,阴极上氢离子得电子发生还原反应,写出总反应方程式.
②电解池中,阳极是阴离子放电,阴极是阳离子放电,氯气能和氢氧化钠反应生成次氯酸钠,可以制得有较强杀菌能力的消毒液;
③铁作阳极,阳极上铁失电子发生氧化反应,阴极上氢离子得电子发生还原反应,写出总反应方程式.
解答:
解:①因电解饱和食盐水的方程式:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,当产生的H2的体积为112mL即0.005mol时,生成氢氧化钠的物质的量为0.01mol,所以溶液中NaOH的物质的量浓度=
=0.1mol/L,
故答案为:0.1mol/L;
②电解氯化钠溶液时,阳极是氯离子失电子生成氯气的过程,阴极是氢离子的电子生成氢气的过程,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,所以一定要让氯气在下边电极产生,所以下边电极是阳极,上边电极是阴极,即a为负极,b为正极,氯气和氢氧化钠反应生成的是氯化钠和次氯酸钠.
故选B.
③铁作阳极,提供亚铁离子,阳极上电极反应式为Fe-2e-=Fe2+,阴极上氢离子得电子生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑),
总反应式为:Fe+2H2O
Fe(OH)2↓+H2↑;
故答案为:Fe;Fe+2H2O
Fe(OH)2↓+H2↑.
| ||
| 0.01mol |
| 0.1L |
故答案为:0.1mol/L;
②电解氯化钠溶液时,阳极是氯离子失电子生成氯气的过程,阴极是氢离子的电子生成氢气的过程,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,所以一定要让氯气在下边电极产生,所以下边电极是阳极,上边电极是阴极,即a为负极,b为正极,氯气和氢氧化钠反应生成的是氯化钠和次氯酸钠.
故选B.
③铁作阳极,提供亚铁离子,阳极上电极反应式为Fe-2e-=Fe2+,阴极上氢离子得电子生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑),
总反应式为:Fe+2H2O
| ||
故答案为:Fe;Fe+2H2O
| ||
点评:本题考查了电解池原理,根据各个电极上发生的电极反应来分析解答.

练习册系列答案
相关题目
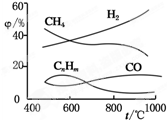 我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )
我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )| A、煤只含有碳、氢、氧三种元素 |
| B、煤中所含的有机物是CH4、CnHm、CO |
| C、温度在580~600℃范围内,CH4、CnHm分解不会生成CO |
| D、800℃以后CnHm分解生成了甲烷和氢气 |
已知常温下Mg(OH)2的Ksp=1.8×10-11.若某氢氧化镁溶液的pH=9,则该溶液中c(Mg2+)最大为( )
| A、0.18mol/L |
| B、1.8×10-2 mol/L |
| C、1.8×10-6 mol/L |
| D、2.0×10-10mol/L |
电子在原子核外排布时,必须遵循的原则是( )
①电子排布在同一能级时,总是优先单独占据不同轨道,且自旋方向相同
②电子排布在不同能级时,总是优先占据能量低的轨道,然后再占据能量高的轨道
③电子排布在同一轨道时,最多只能排2个,且自旋方向必须相反
④电子的排布总是遵循“能量最低原理”“泡利不相容原理”和“洪特规则”
①电子排布在同一能级时,总是优先单独占据不同轨道,且自旋方向相同
②电子排布在不同能级时,总是优先占据能量低的轨道,然后再占据能量高的轨道
③电子排布在同一轨道时,最多只能排2个,且自旋方向必须相反
④电子的排布总是遵循“能量最低原理”“泡利不相容原理”和“洪特规则”
| A、①② | B、②④ | C、①③ | D、②③④ |
下列元素的最外层电子数为5的是( )
| A、H | B、Li | C、Na | D、P |
 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子X、Cl-、OH-、NO3-、CO32-中的一种.
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子X、Cl-、OH-、NO3-、CO32-中的一种.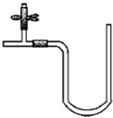 “阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合.综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);B.溶解热效应实验(如硝酸铵溶于水);C.装置的气密性检验实验;D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等.
“阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合.综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);B.溶解热效应实验(如硝酸铵溶于水);C.装置的气密性检验实验;D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等.
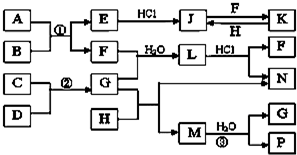 如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).