题目内容
5.以下物质间的每步转化,存在不能通过一步反应实现的是( )| A. | S→SO2→SO3→H2SO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | N2→NO→NO2→HNO3 |
分析 A.硫与氧气反应生成二氧化硫,SO2在催化剂加热条件下生成三氧化硫,SO3和水反应生成硫酸;
B.Fe和稀盐酸反应生成氯化亚铁,氯化亚铁和碱反应生成氢氧化亚铁,氢氧化亚铁被氧化生成Fe(OH)3;
C.Al2O3不溶于水;
D.N2在放电条件下与氧气反应生成NO,继续与氧气反应生成NO2,然后与水反应生成HNO3.
解答 解:A.硫与氧气反应生成二氧化硫,2SO2+O2$\frac{\underline{MnO_2}}{△}$2SO3、SO3+H2O=H2SO4,所以能一步实现,故A不选;
B.Fe+2HCl=FeCl2+H2↑、FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以能一步实现,故B不选;
C.Al2O3不溶于水,所以不能一步实现转化为氢氧化铝,故C选;
D.可通过N2$\stackrel{放电}{→}$NO$\stackrel{氧气}{→}$NO2$\stackrel{水}{→}$HNO3,所以能一步实现,故D不选;
故选C.
点评 本题综合考查元素化合物知识,为高频考点,侧重于元素以及化合物的综合理解和运用的考查,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16. 无机化合物可根据其组成和性质进行分类
无机化合物可根据其组成和性质进行分类
(1)如图所示的物质分类方法的名称是树状分类法.
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.
(3)写出⑦转化为⑤的化学方程式:CO2+2OH-=CO32-+H2O.
(4)写出实验室由⑩制备O2的化学方程式:2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑.
(5)写出③与⑦反应的离子方程式2OH-+CO2=CO32-+H2O
(6)反应Cu+4HNO3(稀)═Cu(NO3)2+2NO2↑+2H2O中,用用单线桥法表示电子得失的方向和数目:
硝酸氧化剂:还原剂铜;若消耗19.2g Cu,则被还原HNO3是0.6mol,转移0.6NA个电子.
 无机化合物可根据其组成和性质进行分类
无机化合物可根据其组成和性质进行分类(1)如图所示的物质分类方法的名称是树状分类法.
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(4)写出实验室由⑩制备O2的化学方程式:2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑.
(5)写出③与⑦反应的离子方程式2OH-+CO2=CO32-+H2O
(6)反应Cu+4HNO3(稀)═Cu(NO3)2+2NO2↑+2H2O中,用用单线桥法表示电子得失的方向和数目:
硝酸氧化剂:还原剂铜;若消耗19.2g Cu,则被还原HNO3是0.6mol,转移0.6NA个电子.
13.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | lmolAl3+离子含有的电子数为3NA | |
| B. | 7lgCl2约含有6.02×1023个筑原子 | |
| C. | 58.5g氯化钠固体中,含1 NA个阴离子 | |
| D. | 欲配制1.00L l.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
20.一定温度下在恒容的容器中发生如下反应:A(s)+2B(g)?C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②混合气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度.
①混合气体的密度 ②混合气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度.
| A. | ①④ | B. | 仅②③ | C. | ②③④ | D. | 仅④ |
10.下列反应既属于氧化还原反应又符合图示能量变化的是( )
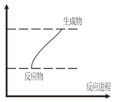

| A. | 灼热的炭与CO2的反应 | B. | 铝片与稀盐酸的反应 | ||
| C. | Ba(OH)2•8H2O和NH4Cl的反应 | D. | 甲烷在氧气中的燃烧反应 |
17.某元素基态原子的外围电子排布为3d54s2,则下列说法错误的是( )
| A. | 该元素为Mn元素 | B. | 该元素最高化合价为+7 | ||
| C. | 该元素属于d区元素 | D. | 该元素原子最外层共有7个电子 |
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示: