题目内容
15.用Na2CO3•10H2O晶体,配制0.2mol•L-1的Na2CO3溶液480mL.(1)应称取Na2CO3•10H2O晶体的质量:28.6g.
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3•10H2O晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体(使用游码) ③碳酸钠晶体不纯,其中混有氯化钠 ④称量碳酸钠晶体时所用砝码生锈 ⑤容量瓶未经干燥使用 其中引起所配溶液浓度偏高的有①④ (填序号,下同),偏低的有②③,无影响的有⑤.
(3)下列操作中,容量瓶所不具备的功能有B、C、E.
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液 E.用来加热溶解固体溶质.
分析 (1)依据配制溶液体积选择合适规格容量瓶,依据m=CVM计算需要溶质的质量;
(2)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(3)容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液等.
解答 解:(1)配制0.2mol•L-1的Na2CO3溶液480mL,应选择500mL容量瓶,需要溶质的质量m=0.2mol•L-1×0.5L×286g/mol=28.6g;
故答案为:28.6g;
(2)①Na2CO3•10H2O晶体失去了部分结晶水,导致溶质的物质的量偏大,溶液浓度偏高;
②用“左码右物”的称量方法称量晶体(使用游码),实际称量质量偏小,溶质的物质的量偏小,溶液浓度偏低;
③碳酸钠晶体不纯,其中混有氯化钠,导致溶质的物质的量偏小,溶液浓度偏低;
④称量碳酸钠晶体时所用砝码生锈,导致称取的溶质的质量偏大,溶液浓度偏高;
⑤容量瓶未经干燥使用,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变;
所以:引起所配溶液浓度偏高的有①④,偏低的有②③,无影响的有⑤;
故答案为:①④;②③;⑤;
(3)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选BCE.
点评 本题主要考查一定物质的量浓度溶液的配制与稀释,注意容量瓶规格的选取方法为易错点,注意误差分析的方法,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
5.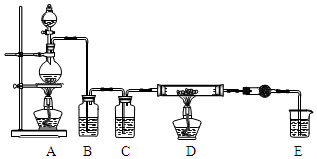 无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
探究一 无水AlCl3的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3.供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液
(1)写出装置A烧瓶中发生的反应方程式MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始前,先检查装置气密性,后装入药品,接下来的步骤依次是bca(填序号)
a.加热D中硬质玻璃管 b.往A烧瓶中加入液体 c.点燃A中的酒精灯
(3)写出无水AlCl3与水蒸气反应的化学方程式AlCl3+3H2O(g)=Al(OH)3+3HCl.
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如表:
(4)根据表中数据,计算所得固体中无水AlCl3的质量分数86.5%.
(5)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有①②③:(填序号)
①制备的氯气不足,②固体和气体无法充分接触,③无水AlCl3发生升华,造成损失.
 无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3,查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.探究一 无水AlCl3的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3.供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液
(1)写出装置A烧瓶中发生的反应方程式MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验开始前,先检查装置气密性,后装入药品,接下来的步骤依次是bca(填序号)
a.加热D中硬质玻璃管 b.往A烧瓶中加入液体 c.点燃A中的酒精灯
(3)写出无水AlCl3与水蒸气反应的化学方程式AlCl3+3H2O(g)=Al(OH)3+3HCl.
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如表:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| D中固体用量 | 2.0g | 2.0g | 2.0g |
| 氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(5)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有①②③:(填序号)
①制备的氯气不足,②固体和气体无法充分接触,③无水AlCl3发生升华,造成损失.
3.在一个绝热的容积固定的密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g)+qD(g),当m、n、p、q为任意整数时,反应达到平衡的标志是:①体系的压强不再改变,②体系的温度不再改变,③各组分的浓度不再改变,④各组分的质量分数不再改变,⑤反应速率,v(A):v(B):v(C):v(D)=m:n:p:q,⑥单位时间内m mol A中化学键断裂的同时有p mol C中化学键也断裂.下列组合完全正确的是( )
| A. | ①③④⑤ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ②③④⑤ |
4.表是稀硫酸与某金属反应的实验数据:
(1)实验4和5表明,固体反应物的表面积对反应速率有影响;
(2)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8或2、5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
| 序号 | 金属质量 g | 金属状态 | c(H2SO4) mol•L-1 | V(H2SO4) mL | 溶液温度/℃ | 金属消失的 时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
(2)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8或2、5(填实验序号);
(3)本实验中影响反应速率的其他因素还有反应温度,
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,故溶液温度变化值相近.
5.以下物质间的每步转化,存在不能通过一步反应实现的是( )
| A. | S→SO2→SO3→H2SO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | N2→NO→NO2→HNO3 |
 ,D中官能团为羧基(-COOH).
,D中官能团为羧基(-COOH). CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.